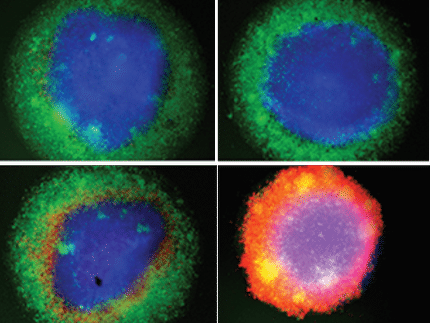
Tumorzellen mit Anziehungskraft
Fachhochschule St. Pölten simuliert & entwickelt Magnetfelder für Tumordiagnostik
Anzeigen
Auf der "55th Annual Conference on Magnetism & Magnetic Materials" in Atlanta, USA, wurde die Simulation der Selbstorganisation von magnetischen Teilchen für biomedizinische Anwendungen vorgestellt. Die Simulation von selbstorganisierten Strukturen ist Teil eines Kooperationsprojektes der Fachhochschule St. Pölten mit der Donau-Universität Krems (DUK), dem Austrian Institute of Technology (AIT) und dem LKH Krems. Das Ziel des Projekts ist es, einen Labor-Chip zu entwickeln, der verschiedene Arten von zirkulierenden Tumorzellen im Blut von Krebspatienten nachweisen kann. Diese kommen extrem selten vor - nur ca. eine Krebszelle kommt im Durchschnitt auf fünf bis zehn Millionen Blutzellen -, können aber wertvolle Auskunft über den Krebs und einen Behandlungsverlauf liefern.
Da bleibt was "hängen"
Der Labor-Chip wird wie ein Miniatursieb wirken, das Krebszellen zurückhält und sie somit anreichert. Und es ist die spezielle Struktur dieses Siebes - und deren Anpassung an die Größe und Form verschiedener Tumorzellarten -, die das Team um Prof. Dr. Thomas Schrefl, Leiter des Master-Studiengangs "Industrial Simulation" an der FH St. Pölten, vor große Herausforderungen stellt. Kernstück des Labor-Chips ist eine Mikrostruktur, die mit Antikörpern beschichtet ist und von Dr. Martin Brandl am Zentrum für Biomedizinische Technologie der DUK entwickelt wird. Diese Antikörper binden ganz speziell Krebszellen und fischen diese quasi aus dem vorbeiströmenden Blut heraus.
Für das effiziente Funktionieren dieser Technologie ist es entscheidend, die genaue Form und Größe dieser Mikrostruktur beeinflussen zu können. Dazu Prof. Schrefl: "Zirkulierende Blutzellen verschiedener Tumorarten unterscheiden sich in Form und Größe und erfordern daher jeweils individuelle räumliche Strukturen der Mikrostruktur, um eingefangen zu werden. Soll ein einzelner Chip für mehrere Tumorarten funktionieren, muss diese Struktur variabel sein. Genau da setzt unser Projekt an, dessen zentrale Idee die Nutzung magnetischer Materialien für die Gestaltung des Siebes ist."
Der Labor-Chip vereint zwar alle wesentlichen Funktionen des Tests auf kleinstem Raum, stellt aber deshalb ganz besondere Anforderungen an seine Konstruktion. Der Porendurchmesser des Mikrosiebes beträgt 0.02 mm bis 0.05 mm. So sind mechanische oder elektrische Manipulationen des Mikrosiebes in dieser Dimension geradezu unmöglich. Eine Anpassung an wechselnde Gegebenheiten schien somit bisher ausgeschlossen. Im Rahmen des von der Life Science Krems GmbH - der Forschungsgesellschaft des Landes Niederösterreich - geförderten Projekts werden Prof. Schrefl und die folgenden Kooperationspartner das nun ändern: Dr. Hubert Brückl - Leiter des Geschäftsfelds Nano Systems des AIT, Dr. Martin Brandl - Zentrum für Biomedizinische Technologie an der DUK und Univ. Prof. Dr. Martin Pecherstorfer - Leiter des Hämatologisch-Onkologischen Dienst des LKH Krems.
Gemeinsam werden diese Partner nun verschiedene magnetische Materialien auf ihre Eignung für den variablen Labor-Chip untersuchen. Dabei kommt Prof. Schrefls spezielle Kombination an Fachwissen voll zum Tragen: Er gilt als internationaler Experte für den Aufbau magnetischen Materials und deren Beschreibung mit mathematischen Algorithmen. Diese Expertise erlaubt es, die vielen möglichen Variationen der Gestaltung des Miniatursiebes - auch als "Micropost" bezeichnet - am Computer zu optimieren und so langwierige Phasen von Versuch & Irrtum abzukürzen. Ein Micropost, der durch kontrollierte Veränderung die Isolierung und Identifikation mehrerer verschiedener Tumorzellarten erlaubt, scheint damit näher gerückt.
Nadel im Heuhaufen - Magnet bietet Lösung
Insgesamt werden die Kooperationspartner drei Materialien testen, die es erlauben sollen, den Micropost kontrolliert herzustellen und anschließend zu manipulieren. So genannte Ferrofluide werden dabei genauso getestet werden wie selbst-organisierende magnetische Teilchen und magnetisch aktive Polymere. Denn trotz unterschiedlicher Eigenschaften ist allen drei magnetischen Materialien eines gemeinsam: Ihre räumliche Struktur lässt sich durch ein externes Magnetfeld verändern. So kann ein Micropost, der aus diesem Material gefertigt wurde, auch später noch manipuliert und an verschiedene Tumorarten angepasst werden. Genau das ist die Vorausetzung dafür, dass ein einzelner Labor-Chip unterschiedliche Tumorzellen erkennen kann.
Gemeinsam mit dem Know-how der Partner erlaubt Prof. Schrefls Expertise im Bereich magnetischer Materialien und seine Kenntnisse über die Simulation entsprechender Vorgänge, die optimale Lösung für genau diese Art des Tumor-Diagnosechips an der FH St. Pölten zu entwickeln.
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Antikörper
Antikörper sind spezialisierte Moleküle unseres Immunsystems, die gezielt Krankheitserreger oder körperfremde Substanzen erkennen und neutralisieren können. Die Antikörperforschung in Biotech und Pharma hat dieses natürliche Abwehrpotenzial erkannt und arbeitet intensiv daran, es therapeutisch nutzbar zu machen. Von monoklonalen Antikörpern, die gegen Krebs oder Autoimmunerkrankungen eingesetzt werden, bis hin zu Antikörper-Drug-Konjugaten, die Medikamente gezielt zu Krankheitszellen transportieren – die Möglichkeiten sind enorm.
Themenwelt Antikörper
Antikörper sind spezialisierte Moleküle unseres Immunsystems, die gezielt Krankheitserreger oder körperfremde Substanzen erkennen und neutralisieren können. Die Antikörperforschung in Biotech und Pharma hat dieses natürliche Abwehrpotenzial erkannt und arbeitet intensiv daran, es therapeutisch nutzbar zu machen. Von monoklonalen Antikörpern, die gegen Krebs oder Autoimmunerkrankungen eingesetzt werden, bis hin zu Antikörper-Drug-Konjugaten, die Medikamente gezielt zu Krankheitszellen transportieren – die Möglichkeiten sind enorm.