Chaperone kontrollieren den Aufbau von Eiweißfabriken in der Zelle
Mikrobiologen der Universität Konstanz um Elke Deuerling entdecken in Hefezellen eine neuartige Funktion von Chaperonen
Die Forschungsgruppe von Elke Deuerling, Professorin für Molekulare Mikrobiologie an der Universität Konstanz, entdeckte neue Funktionen der als „Chaperone“ bekannten Proteinfaltungshelfer. Die Konstanzer Wissenschaftler bewiesen, dass Chaperone nicht nur wie bislang angenommen für die korrekte Faltung von Proteinen zuständig sind, sondern auch für die Funktionalität der Ribosomen unerlässlich sind. Damit nehmen Chaperone eine bislang unbekannte Schlüsselstellung in zellulären Prozessen ein.
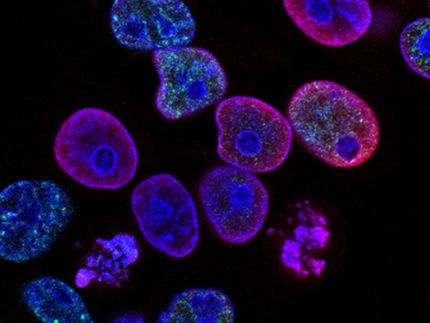
In allen Zellen sind sogenannte Chaperone als molekulare Faltungshelfer für die dreidimensionale Strukturgebung (Faltung) neu entstehender Proteine zuständig - erst wenn das jeweilige Protein seine korrekte räumliche Struktur erhalten hat, kann es in der Zelle seine oft lebenswichtigen Aufgaben erfüllen. Bestimmte Chaperone binden dafür direkt an die sogenannten Ribosomen, die zellulären Eiweißfabriken, die Proteine herstellen. Dadurch wird die wachsende Proteinkette so früh wie möglich in ihrer richtigen Faltung unterstützt.
Die Mikrobiologen um Professor Dr. Elke Deuerling veröffentlichten in der Wissenschaftszeitschrift „Journal of Cell Biology“ ihre Entdeckung, dass bestimmte Chaperone auch für die reibungslose Funktion der Ribosomen selbst unerlässlich sind: Sie helfen beim Zusammenbau der komplexen ribosomalen Untereinheiten. Wenn dieser Prozess gestört ist, gibt es weniger funktionstüchtige Ribosomen und viele Proteine können nicht wie benötigt hergestellt werden - für die Zelle eine enorme Belastung, unter der sie nur noch sehr langsam wachsen kann.
Mit molekularbiologischen Techniken verhinderten die Mikrobiologen in Hefezellen die Bildung zweier Chaperonsysteme namens SSB-RAC und NAC und untersuchten den Effekt auf das Wachstum der Zellen. Fehlten beide Chaperone, wuchsen die Zellen deutlich schlechter als unbehandelte Kontrollzellen. In den Mutantenzellen befanden sich Ansammlungen von zusammengelagerten ribosomalen Bausteinen, darunter ribosomale Proteine und weitere Proteine, die für den Zusammenbau von Ribosomen notwendig sind. Die Zahl der korrekt zusammengesetzten, funktionellen Ribosomen war deutlich niedriger als in unbehandelten Wildtypzellen.
Dieses Ergebnis zeigt, dass die beiden Chaperonsysteme nicht nur eine, sondern zwei zentrale Funktionen in der Zelle besitzen. Sie sorgen dafür, dass neu hergestellte Proteine sich richtig falten und dadurch erst richtig arbeiten können. Zudem kontrollieren sie auch, wie viele Proteinsynthesefabriken überhaupt in der Zelle vorhanden sind, um neue Proteine herzustellen. Damit nehmen sie eine Schlüsselstellung im zellulären Geschehen ein, denn sowohl die korrekte Faltung als auch die Menge der verschiedenen Proteine in einer Zelle sind für deren Funktionalität und Lebensfähigkeit entscheidend.
Für Elke Deuerling und ihr Team ergeben sich aus ihren Forschungsergebnissen neue Fragen. Zu klären ist, ob diese Chaperonsysteme auch den Alterungsprozess von Zellen beeinflussen. Außerdem untersuchen die Forscher, ob diese Chaperone auch solche Proteine kontrollieren, die bei Fehlfaltungen schwere Krankheiten auslösen können, wie etwa Parkinson oder Alzheimer. Im Vordergrund der Forschung steht dabei die Analyse der molekularen Grundlagen dieser Prozesse, um zu verstehen, wie diese Chaperone funktionieren. Die nähere Erforschung dieser Zusammenhänge wird Elke Deuerling in ihrer Forschungsinitiative an der Universität Konstanz im Rahmen der Exzellenzinitiative des Bundes und der Länder weiterführen.
Originalveröffentlichung: Koplin, A, Preissler, S, Ilina, Y, Koch, M, Scior, A, Erhardt, M, & Deuerling E; "A dual function for chaperones Ssb-RAC and the NAC nascent polypeptide-associated complex on ribosomes"; Journal of Cell Biology (2010), Ausgabe 189; S. 57-68