Epigenetische Veränderung programmiert Astrozyten zu Hirnstammzellen um
Entdeckung zeigt, dass Astrozyten möglicherweise für die regenerative Medizin genutzt werden könnten, um geschädigte Nervenzellen zu ersetzen
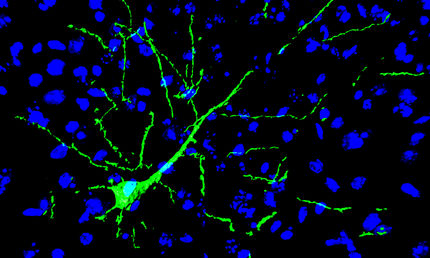
Ruhende Hirnstammzellen unterscheiden sich kaum von normalen Astrozyten, die im Gehirn die Nervenzellen unterstützen. Wie können nahezu identische Zellen so unterschiedliche Funktionen wahrnehmen? Der Schlüssel liegt in der Methylierung ihres Erbguts, die diesen speziellen Astrozyten Stammzell-Eigenschaften verleiht. Das veröffentlichen Wissenschaftlerinnen und Wissenschaftler vom Deutschen Krebsforschungszentrum (DKFZ) und der Universität Heidelberg in der Fachzeitschrift Nature. Die Forschenden zeigten an Mäusen, dass experimentell ausgelöster Durchblutungsmangel im Gehirn die Astrozyten epigenetisch zu Hirnstammzellen umprogrammiert, die wiederum Nervenvorläuferzellen hervorbringen können. Diese Entdeckung zeigt, dass Astrozyten möglicherweise für die regenerative Medizin genutzt werden könnten, um geschädigte Nervenzellen zu ersetzen.
Im Gehirn arbeiten viele verschiedene Zellarten zusammen. Bei Menschen machen die Nervenzellen (Neuronen) weniger als die Hälfte der Zellen aus. Der Rest wird als „Glia" bezeichnet. Die häufigsten Gliazellen sind Astrozyten. Sie versorgen die Neuronen mit Nährstoffen, bilden einen Teil der Blut-Hirn-Schranke, regulieren die Synapsen und unterstützen die Abwehrzellen.
Ein kleiner Anteil der Astrozyten ist jedoch in der Lage, Nervenzellen und andere Arten von Gehirnzellen hervorzubringen. Diese speziellen Astrozyten werden daher auch als Hirnstammzellen bezeichnet. Hirnstammzellen und gewöhnliche Astrozyten unterscheiden sich kaum in ihrer Genexpression, also in der Aktivität ihrer Gene. „Wie sie so unterschiedliche Funktionen ausüben können und was die Stammzell-Eigenschaften ausmacht, war bislang völlig unklar", erklärt Ana Martin-Villalba, Stammzellforscherin am DKFZ.
Methylierung ist der Schlüssel
Um dieses Rätsel zu lösen, isolierten die Teams um Martin-Villalba und Simon Anders vom BioQuant-Zentrum der Universität Heidelberg sowohl gewöhnliche Astrozyten als auch Hirnstammzellen aus einer der Regionen des Gehirns, in der auch bei ausgewachsenen Mäusen noch junge Neuronen entstehen, der „ventrikulär-subventrikulären Zone" (vSVZ). Die Forschenden analysierten dazu auf Ebene einzelner Zellen die Genexpression durch mRNA-Sequenzierung sowie die Muster der Methylierung („Methylom") im gesamten Erbgut. Dabei half ein eigens entwickeltes Tool zur Analyse der Methylierungsdaten*.
Unter DNA-Methylierung versteht man chemische „Markierungen", mit denen die Zelle ungenutzte Teile ihrer DNA abschalten kann. Dadurch ist die Methylierung entscheidend für die Identität der Zellen.
Den Stammzellexperten fiel bei dieser Untersuchung auf, dass Hirnstammzellen ein besonderes DNA-Methylierungsmuster aufweisen, dass sie von anderen Astrozyten unterscheidet. „Anders als bei gewöhnlichen Astrozyten sind in Hirnstammzellen bestimmte Gene demethyliert, die sonst nur von Nervenvorläuferzellen verwendet werden. Dadurch ist es den Hirnstammzellen möglich, diese Gene zu aktivieren, um selbst Nervenzellen hervorzubringen", erklärt Lukas Kremer, Erstautor der aktuellen Publikation. Ko-Erstautor Santiago Cerrizuela ergänzt: „Dieser Weg ist gewöhnlichen Astrozyten verwehrt, da die erforderlichen Gene durch DNA-Methylierung blockiert werden."
Mangeldurchblutung löst Umprogrammierung von Astrozyten zu Stammzellen aus und steigert Nerven-Neubildung
Könnten sich durch Methylierung auch in anderen Regionen des Gehirns, außerhalb der vSVZ, Astrozyten zu Hirnstammzellen umwandeln lassen? „Das wäre ein wichtiger Schritt für die regenerative Medizin, um geschädigte Hirnareale wieder zu reparieren", sagt Ana Martin-Villalba.
Ältere Studien hatten bereits gezeigt, dass Durchblutungsmangel, wie er beispielsweise bei Hirnverletzungen oder Schlaganfällen auftritt, die Anzahl der neugeborenen Nervenzellen steigert. Spielen dabei veränderte Methylierungsprofile eine Rolle? Um das zu untersuchen, unterbrachen die Forschenden bei Mäusen für kurze Zeit die Blutversorgung des Gehirns. Wenig später ließen sich auch außerhalb der vSVZ Astrozyten mit dem typischen Stammzell-Methylierungsprofil nachweisen, außerdem eine erhöhte Anzahl von Nervenvorläuferzellen.
„Unsere Theorie ist, dass normale Astrozyten im gesunden Gehirn keine Nervenzellen bilden, weil ihr Methylierungsmuster sie daran hindert", erklärt Studienleiterin Martin-Villalba. „Techniken zur gezielten Veränderung des Methylierungsprofils könnten einen neuen therapeutischen Ansatz darstellen, um neue Neuronen zu erzeugen und Nervenerkrankungen zu behandeln."
„Der Durchblutungsmangel bewirkt offenbar, dass Astrozyten in bestimmten Bereichen des Gehirns die Methylmarkierungen auf ihrer DNA so umverteilen, dass ihr Stammzellen-Programm zugänglich wird. Daraufhin beginnen sich die umprogrammierten Zellen zu teilen und Vorläufer für neue Neuronen zu bilden", fasst Simon Anders zusammen und ergänzt: „Wenn wir diese Vorgänge besser verstehen, können wir möglicherweise in Zukunft die Bildung neuer Neuronen gezielt stimulieren. So könnten wir z.B. nach einem Schlaganfall die Selbstheilungskräfte des Gehirns, die im Normalfall einfach nicht genügend zum Einsatz zu kommen scheinen, so stärken, dass der Schaden repariert werden kann".