Dem Nachbarn einen Zettel zustecken: der zelluläre Weg
Wie Zellen sich gegenseitig Nachrichten schicken
Anzeigen
Forscher haben neue Erkenntnisse darüber gewonnen, wie Medikamente an Connexin-Moleküle binden. Diese Moleküle bilden Kanäle, die es benachbarten Zellen ermöglichen, direkte Nachrichten aneinander zu senden. Funktionsstörungen dieser Kanäle sind an neurologischen und kardialen Erkrankungen beteiligt. Das neue Verständnis darüber, wie Medikamente an sie binden und auf sie einwirken, dürfte die Entwicklung von Therapien zur Behandlung solcher Erkrankungen erleichtern.
Heutzutage nutzen wir viele elektronische Kommunikationsmittel, aber manchmal ist es am wirkungsvollsten, einen Zettel in den Briefkasten des Nachbarn zu werfen oder einen Kuchen vor die Haustür zu stellen. Auch Zellen haben Möglichkeiten, direkte Nachrichten an ihre Nachbarn zu senden.
Benachbarte Zellen können über relativ große Kanäle, die so genannten Gap Junctions, direkt miteinander kommunizieren. Diese Kanäle ermöglichen es den Zellen, kleine Moleküle und Ionen ungehindert miteinander oder mit der äußeren Umgebung auszutauschen. Auf diese Weise können sie die Aktivitäten in den Geweben oder Organen, aus denen sie bestehen, koordinieren und die Homöostase aufrechterhalten.
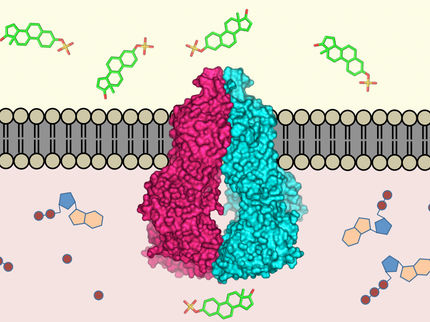
Solche Kanäle werden von Proteinen gebildet, die als Connexine bekannt sind. Sechs Connexine, die sich in der Zellmembran befinden, bilden einen Hemikanal, der sich mit einem Hemikanal in einer benachbarten Zelle verbindet, um einen Zwei-Wege-Kanal zu bilden.
Wenn Connexin-Kanäle nicht richtig funktionieren, verursachen sie Veränderungen in der interzellulären Kommunikation, die mit vielen verschiedenen Krankheiten in Verbindung gebracht werden. Dazu gehören Herzrhythmusstörungen, Erkrankungen des zentralen Nervensystems wie Epilepsie, neurodegenerative Erkrankungen und Krebs.
Infolgedessen wird nach Medikamenten gesucht, die auf Connexine abzielen. Das Verständnis der Struktur der Connexine und der Art und Weise, wie Medikamente an Connexin-Kanäle binden, um sie zu blockieren oder zu aktivieren, ist jedoch begrenzt. Von den einundzwanzig Connexin-Arten, die beim Menschen bekannt sind, werden derzeit nur wenige als Angriffspunkte für Medikamente untersucht.
Eine Erklärung für die Nebenwirkungen von Malariamitteln?
Nun haben Forschende des PSI, der ETH Zürich und der Universität Genf unser Verständnis der Connexin-Kanäle und ihrer Bindung an Medikamentenmoleküle vertieft. Die Studie ist in der Zeitschrift Cell Discovery veröffentlicht.
Das untersuchte Connexin ist als Connexin-36, kurz Cx36, bekannt. Cx36 spielt eine wichtige Rolle in der Bauchspeicheldrüse und im Gehirn, wo es die Insulinsekretion und die neuronale Aktivität steuert. Erhöhte Werte von Cx36-Kanälen wurden bei Patienten mit Epilepsie nach traumatischen Hirnverletzungen festgestellt. Es wird vermutet, dass die erhöhte Aktivität der Gap-Junction-Kanäle zum Absterben von Neuronen führt. Daher war das Team an Medikamenten interessiert, die diese Kanäle hemmen.
Das Team untersuchte Cx36, das an das Malariamittel Mefloquin (Markenname Lariam) gebunden ist. Das Medikament wirkt bekanntlich auf die Parasiten, die Malaria verursachen, wenn sie von infizierten Mücken in den Blutkreislauf gelangen. Forschungen haben jedoch ergeben, dass Mefloquin auch an Cx36 in unseren Zellen bindet, was einige der bekannten schweren neuropsychiatrischen Nebenwirkungen des Medikaments erklären könnte.
Mit Hilfe der Kryo-Elektronenmikroskopie nahm das Forscherteam hochauflösende Strukturen von Cx36-Gap-Junction-Kanälen mit und ohne Mefloquin auf. Sie sahen, wie das Medikamentenmolekül an jedes der sechs Connexine, aus denen der Kanal besteht, bindet. Die Bindungsstelle ist in der Pore des Kanals vergraben, so dass sechs Moleküle den Kanal effektiv schließen.
Computersimulationen von Mitarbeitern der Universität Genf halfen dem Team zu verstehen, wie sich die Bindung von Mefloquin auf die Fähigkeit des Kanals, Ionen durchzulassen, auswirken würde. Auf diese Weise konnten sie zeigen, dass die Bindung des Medikaments den Fluss von gelösten Stoffen durch den Kanal einschränkt.
Ein Ausgangspunkt für die strukturbasierte Arzneimittelentdeckung bei Connexinen
Die Forscher hoffen, dass dieses neue Strukturwissen ein Ausgangspunkt für die Entwicklung neuer Medikamente mit größerer Spezifität für bestimmte Connexin-Kanäle sein wird.
"Unsere Studie zeigt, wie ein Medikamentenmolekül in der Pore des Kanals landet, und gibt durch unsere Simulationen eine plausible Erklärung dafür, wie das Medikament den Kanal hemmt", sagt Volodymyr Korkhov, Gruppenleiter am PSI und ausserordentlicher Professor an der ETH Zürich, der die Studie leitete. "Dies ist nicht nur für Cx36 von Bedeutung, sondern auch für die umfassendere Frage der Wechselwirkungen zwischen Connexin und Medikamenten."
Die neusten Erkenntnisse ergänzen andere Forschungsaktivitäten der PSI/ETHZ-Gruppe zu Connexinen: insbesondere die Struktur von Connexin 43 in geschlossener Konformation und die Frage, wie Struktur und Funktion von Connexin 32, das eine Rolle im peripheren Nervensystem spielt, zusammenhängen.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.