Hat das menschliche Gehirn eine Achillesferse, die zu Autismus führt?
Ein einziges Hirnorganoid enthüllt genetische Grundlagen
Mit einem revolutionären System, das Hirnorganoid-Technologie und komplexe Genetik kombiniert, ist es nun möglich, die Auswirkungen mehrerer Mutationen gleichzeitig und in einzelnen Zellen in menschlichen Hirnorganoiden zu untersuchen. Forscher:innen der Knoblich-Gruppe am Institut für Molekulare Biotechnologie (IMBA) der Österreichischen Akademie der Wissenschaften und der Treutlein-Gruppe an der ETH Zürich entwickelten diese Technologie, mit der Zelltypen und genregulatorische Netzwerke, die Autismus zugrunde liegen, identifiziert werden können. Diese innovative Methode bietet einen beispiellosen Einblick in eine der komplexesten Störungen des menschlichen Gehirns. Die Ergebnisse wurden am 13. September in Nature veröffentlicht.
Das menschliche Gehirn nutzt einzigartige Prozesse, um sich zu entwickeln und einen vielschichtigen und vernetzten Kortex aufzubauen. Diese einzigartigen Prozesse tragen jedoch auch zu häufigeren neurologischen Entwicklungsstörungen beim Menschen bei. So sind beispielsweise viele Gene, die ein hohes Risiko für die Entwicklung einer Autismus-Spektrum-Störung (ASD) mit sich bringen, für die Entwicklung des Kortex entscheidend. Obwohl klinische Studien einen kausalen Zusammenhang zwischen mehreren Genmutationen und Autismus gezeigt haben, ist immer noch unklar, wie diese Mutationen zu Entwicklungsstörungen des Gehirns führen. Da die menschliche Gehirnentwicklung einzigartig ist, sind Tiermodelle nur begrenzt aussagekräftig. „Nur ein menschliches Modell des Gehirns kann die Komplexität und die Einzigartigkeit des menschlichen Gehirns widerspiegeln“, sagt Jürgen Knoblich, wissenschaftlicher Direktor des IMBA und einer der korrespondierenden Autoren der Studie.
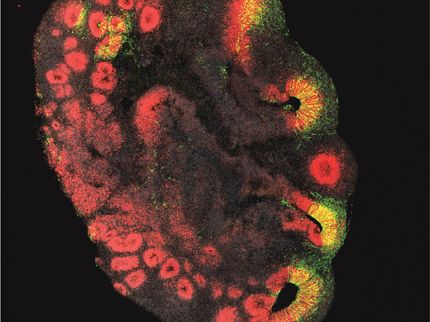
Um diese Black Box zu knacken, entwickelten Forscher:innen aus den Arbeitsgruppen von Jürgen Knoblich und Barbara Treutlein am IMBA und der ETH Zürich eine Technik namens „CHOOSE“ (CRISPR-human-organoids-scRNA-seq). Mit dieser Technik kann ein kompletter Satz von DNA-Transkriptionsregulatorgenen, die mit Autismus in Verbindung stehen, untersucht werden. Was die Technik so besonders macht, ist, dass die Gene gleichzeitig in einem einzigen Organoid untersucht werden können. Im CHOOSE-System trägt jede Zelle im Organoid nicht mehr als eine einzelne Mutation in einem bestimmten ASD-Gen. Die Forscher:innen konnten die Auswirkungen jeder Mutation auf Einzelzellebene verfolgen und den Entwicklungsverlauf jeder Zelle abbilden. „Mit dieser Hochdurchsatz-Methode können wir systematisch eine Liste von krankheitsverursachenden Genen inaktivieren. Während die Organoide, die diese Mutationen tragen, wachsen, analysieren wir die Auswirkung jeder Mutation auf die Entwicklung jedes Zelltyps“, sagt der Erstautor und mitkorrespondierende Autor der Studie, Chong Li, ein Postdoktorand in der Knoblich-Gruppe.
Ein systematischer Ansatz mit hohem Durchsatz
Mit dem CHOOSE-System machen die Teams des IMBA und der ETH Zürich einen großen Schritt vorwärts in der Erforschung krankheitsverursachender Gene. Das System bietet Forschenden eine vielseitige Hochdurchsatzmethode, die für verschiedene Krankheiten und menschliche Modellsystem angewendet werden kann. CHOOSE beschleunigt die Analyse im Vergleich zu herkömmlichen genetischen Loss-of-Function-Ansätzen erheblich. „Wir können die Folgen jeder Mutation in einem einzigen Experiment sehen und so die Analysezeit im Vergleich zu traditionellen Methoden drastisch verkürzen, und das mit einem Ansatz, der jahrzehntelang nur in Organismen wie der Fruchtfliege möglich war“, erklärt Knoblich. „Zusätzlich können wir noch von hundert Jahren wissenschaftlicher Literatur über krankheitsverursachende Gene profitieren.“
Dadurch, dass mehrere Gene parallel im Organoid mutiert und ihre Auswirkungen weiterverfolgt werden, entsteht eine enorme Menge an Daten. Um diesen komplexen Datensatz zu analysieren, nutzten die mitkorrespondierende Autorin Barbara Treutlein und ihr Team an der ETH Zürich quantitative Bioinformatik- und Machine-Learning-Ansätze. „Anhand dieser Einzelzell-Expressionsdaten mit hohem Durchsatz können wir quantifizieren, ob ein bestimmter Zelltyp aufgrund einer bestimmten Mutation mehr oder weniger häufig vorkommt. Zusätzlich können wir Sätze von Genen identifizieren, die häufig von jeder Mutation betroffen sind. Durch den Vergleich aller Genmutationen können wir die phänotypische Landschaft dieser krankheitsbedingten genetischen Störungen rekonstruieren“, erklärt Treutlein.
Neue Erkenntnisse über Autismus während der Entwicklung
Mithilfe des CHOOSE-Systems konnten die Forscher:innen zeigen, dass Mutationen in 36 Genen, von denen bekannt ist, dass sie ein hohes Autismus-Risiko verursachen, zu spezifischen Veränderungen in den Zelltypen des sich entwickelnden Gehirns führen. Sie identifizierten kritische Transkriptionsveränderungen, die durch gemeinsame Netzwerke, so genannte „Genregulationsnetzwerke“ oder GRNs, reguliert werden. „Ein GRN ist eine Gruppe von molekularen Regulatoren, die miteinander interagieren, um eine bestimmte Zellfunktion zu steuern“, erklärt Li. „Wir haben gezeigt, dass einige Zelltypen während der Gehirnentwicklung anfälliger sind als andere. Wir haben auch die Netzwerke identifiziert, die am anfälligsten für Autismus-Mutationen sind“, fügt er hinzu.
„Mit diesem Ansatz haben wir gelernt, dass Autismus-verursachende Gene einige gemeinsame molekulare Mechanismen haben“, sagt Knoblich. Diese gemeinsamen Mechanismen können jedoch in verschiedenen Zelltypen zu sehr unterschiedlichen Auswirkungen führen. „Einige Zelltypen sind anfälliger für Mutationen, die zu Autismus führen, insbesondere einige neurale Vorläuferzellen - die Gründerzellen, aus denen Neuronen entstehen. Dies geht so weit, dass die Pathologie des Autismus bereits in der frühen Phase der Gehirnentwicklung auftreten könnte. Dies deutet darauf hin, dass einigen Zelltypen bei der Untersuchung von Autismusgenen in Zukunft mehr Aufmerksamkeit geschenkt werden muss“, sagt Li.
Um zu überprüfen, ob diese Ergebnisse für Erkrankungen relevant sind, stellten die Forscher:innen gemeinsam mit Kliniker:innen der Medizinischen Universität Wien Gehirnorganoide aus zwei Stammzellproben von Patient:innen her. Beide Patient:innen hatten Mutationen in demselben Autismus-verursachenden Gen. „Die von beiden Patient:innen erzeugten Organoide zeigten deutliche Entwicklungsdefekte, die mit einem bestimmten Zelltyp verbunden waren. Wir konnten diese In-vitro-Beobachtungen validieren, indem wir die Organoid-Strukturen mit den pränatalen MRT-Aufnahmen des Gehirns eines der Patient:innen verglichen“, sagt Knoblich. Wie Knoblich betont, stimmen die Organoid-Daten eng mit den klinischen Beobachtungen überein.
Jenseits von Gehirn und Autismus...
Das Team gewann damit nicht nur einzigartige Einblicke in die Pathologie des Autismus, sondern zeigte auch die Vielseitigkeit und Übertragbarkeit des CHOOSE-Systems. „Wir gehen davon aus, dass unsere Technik über Hirnorganoide hinaus zur Untersuchung verschiedener krankheitsassoziierter Gene eingesetzt werden kann“, sagt Knoblich. Mit dieser neuen Technik steht Wissenschaftler:innen und Kliniker:innen ein robustes und präzise Hochdurchsatz-Screening-Tool zur Verfügung, das die Analysezeit erheblich verkürzt und neue Einblicke in Krankheitsmechanismen ermöglicht.
Originalveröffentlichung
Chong Li, Jonas Simon Fleck, Catarina Martins-Costa, Thomas R. Burkard, Jan Themann, Marlene Stuempflen, Angela Maria Peer, Ábel Vertesy, Jamie B. Littleboy, Christopher Esk, Ulrich Elling, Gregor Kasprian, Nina S. Corsini, Barbara Treutlein, Juergen A. Knoblich; "Single-cell brain organoid screening identifies developmental defects in autism"; Nature, Volume 621, 2023-9-13