Miniproteine aus dem „Nichts“
"Ergebnisse eröffnen eine Vielzahl an neuen Forschungsmöglichkeiten"
Tausende von ihnen wurden erst kürzlich entdeckt und sind beim Menschen einzigartig: evolutionär junge Miniproteine. Im Journal „Molecular Cell“ beschreibt Norbert Hübner in Zusammenarbeit mit u.a. dem BIH ihre Entstehungsgeschichte und ihren womöglich wichtigen Einfluss auf zelluläre Prozesse.
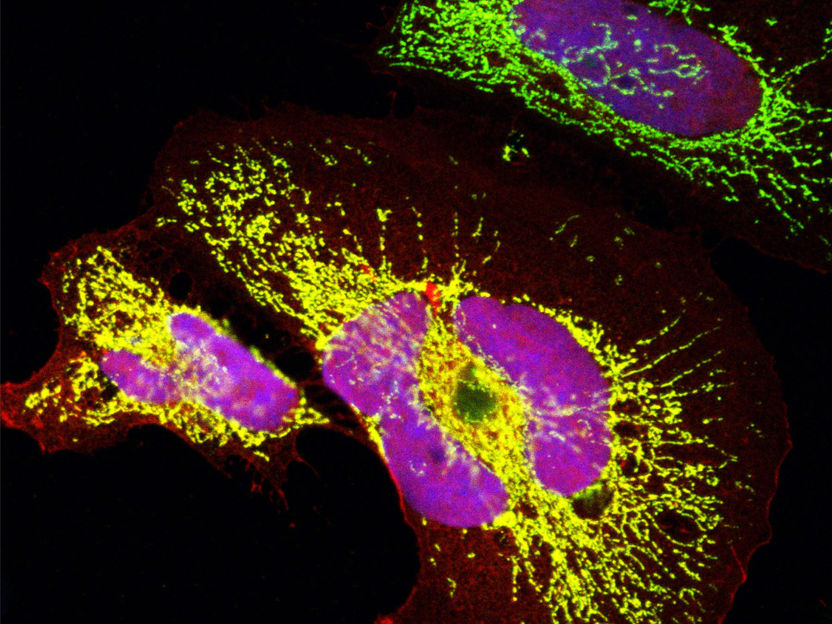
Ein evolutionär junges Protein, dass sich de novo in Altweltaffen entwickelt hat: Das Miniprotein in Mitochondrien (grün) & im Zellkern (blau) wurde in Humanzellen überexprimiert. Signal des Proteins überschneidet sich mit beiden Bereichen (gelb & rosa).
Clara Sandmann, Max Delbrück Center
Dass kleine Strukturen bisweilen eine große Wirkung haben, ist in der Biologie ein alter Hut: Millionen an Signalmolekülen, Hormonen oder anderen Biomolekülen tummeln sich in den Zellen und im Gewebe und sind an vielen grundlegenden Prozessen im Körper ausschlaggebend beteiligt. Trotz dieses Wissens haben Biologen und Medizinerinnen eine bestimmte Klasse an Proteinen lange Zeit ignoriert: zu klein, nur beim Menschen und bei Primaten verbreitet und daher unbedeutend und ohne Funktion, so ihre Annahme. Die Entdeckungen von Professor Norbert Hübner am Max Delbrück Center und Dr. Sebastiaan van Heesch vom Princess Máxima Center for Pediatric Oncology in den Niederlanden, haben diese Sichtweise vor einigen Jahren verändert: „Wir waren die ersten, die die Existenz von Tausenden neuer Mikroproteine in menschlichen Organen nachgewiesen haben“, erzählt Hübner.
In Fachmagazin „Molecular Cell“ berichtet das Team um Hübner und van Heesch nun, wie sie diese Miniproteine systematisch untersuchten – und was sie daraus lernten: „Wir konnten zeigen, in welchen Erbgutsequenzen die Mikroproteine kodiert werden und wann DNA-Veränderungen im Laufe der Evolution hinzugekommen sind“, erklärt Dr. Jorge Ruiz-Orera. Der Evolutionsbiologe aus Hübners Arbeitsgruppe ist einer der drei Erstautor*innen der Publikation, die am Max Delbrück Center und am Deutschen Zentrum für Herz-Kreislaufforschung (DZHK) arbeiten. Seine bioinformatischen Genanalysen offenbarten, dass die meisten menschlichen Mikroproteine im Evolutionsprozess Millionen von Jahren später entstanden sind als die bislang bekannten größeren Vertreter.
Der extreme Altersunterschied hält die Proteine aber offenbar nicht davon ab, „miteinander zu sprechen“: „In unseren Laborexperimenten zeigte sich, dass die jungen und die alten Proteine aneinander binden können – und sich auf diese Weise möglicherweise gegenseitig beeinflussen“, sagt Erstautorin Dr. Jana Schulz, Forscherin in Hübners Team und am DZHK. Sie vermutet daher, dass die Mikroproteine anders als lange angenommen bei unterschiedlichen Funktionen der Zelle eine wichtige Rolle spielen. Zudem könnten die jungen Proteine bei vergleichsweise schnellen „Innovationen und Anpassungsprozessen“ in der evolutionären Entwicklung maßgeblich beteiligt sein. „Womöglich ist die Evolution dynamischer, als man bislang angenommen hat“, sagt van Heesch.
Proteine, die es nur im Menschen gibt
Überrascht hat die Forscher*innen, dass die extrem viel jüngeren Mikroproteine mit der wesentlich älteren Generation interagieren können, wie Experimente mit einer 2017 am Max Delbrück Center entwickelten biotechnischen Screeningmethode zeigten. In Zusammenarbeit mit Dr. Philipp Mertins und der Proteomics Plattform, die das Max Delbrück Center gemeinsam mit dem Berlin Institute of Health in der Charite (BIH) betreibt, wurden die Miniproteine an eine Oberfläche gekoppelt. Anschließend wurde eine Lösung zugegeben, die die meisten bekannten Proteine einer menschlichen Zelle enthält. Mit raffinierten experimentellen und computergestützen Analysemethoden ließen sich so einzelne Bindungspaare bestimmen. „Die Tatsache, dass ein Mikroprotein an ein anderes Protein koppelt, bedeutet nicht unbedingt, dass es die Funktionsweise dieses Proteins oder Prozesse, an dem das Protein beteiligt ist, beeinflusst“, erklärt Schulz. Gleichwohl deute die Fähigkeit zur Bindung darauf hin, dass es eine Chance auf funktionale Wechselwirkung gebe. Erste zelluläre Experimente, die am Max Delbrück Center in Zusammenarbeit mit den Professoren Michael Gotthardt und Thomas Willnow durchgeführt wurden, bekräftigen diese Annahme. Daher vermutet Ruiz-Orera: „Die Mikroproteine könnten zelluläre Prozesse beeinflussen, die Millionen von Jahren älter sind als sie selbst, da einige alte Proteine schon bei den frühesten Lebewesen vorhanden waren.“
Im Gegensatz zu den bekannten, alten Proteinen, die in unserem Genom kodiert sind, seien die meisten Mikroproteine gewissermaßen „aus dem Nichts entstanden – also aus DNA-Regionen, die vorher nicht für die Proteinherstellung zuständig waren“, berichtet Ruiz-Orera. Anders als der »herkömmliche« und deutlich einfachere Weg, wurden die Mikroproteine also nicht von anderen bereits existierenden Exemplaren kopiert und abgeleitet. Und da diese kleinen Proteine erst während der Evolution des Menschen entstanden sind, fehlen sie außerdem in den Zellen der meisten anderen Tiere, wie Mäusen, Fischen oder Vögeln. Allerdings haben diese Tiere wiederum eine Reihe eigener junger, kleiner Proteine.
Rekord: die kleinsten Proteine
Zusätzlich entdeckten die Forscher*innen in ihren Untersuchungen die kleinsten bislang bekannten menschlichen Proteine: „Wir fanden über 200 superkleine Proteine, von denen jedes kleiner als 16 Aminosäuren ist“, berichtet Dr. Clara Sandmann, ebenfalls Erstautorin der Studie. Aminosäuren sind die einzelnen Bausteine von Proteinen. Laut der Forscherin werfe dies die Frage auf, wie klein ein Protein sein kann beziehungsweise wie groß es sein muss, um noch funktionstüchtig zu sein. Normalerweise bestehen Proteine aus mehreren hundert Aminosäuren.
Die bisher bekannten kleinen Proteine, sogenannte Peptide, die als Hormone oder Signalmoleküle fungieren, werden im Rahmen ihrer Entstehung stets von größeren Vorläuferproteinen abgespalten. „Unsere Arbeit zeigt nun, dass Peptide in einem ähnlichen Größenbereich auch anders hervorgehen können“, sagt Sandmann. Auch diese Kleinsten der Kleinen können sehr spezifisch an größere Proteine binden; ob sie aber als Hormone oder ähnliches wirken können, ist noch unklar: „Bislang wissen wir noch nicht, was die meisten dieser Mikroproteine in unserem Körper machen.“
Gleichwohl habe man zum ersten Mal überhaupt eine Idee davon bekommen, wozu diese Moleküle fähig sind, betont van Heesch. „Diese ersten Ergebnisse eröffnen eine Vielzahl an neuen Forschungsmöglichkeiten.“ Offenkundig seien die Mikroproteine viel zu wichtig, als dass man sie weiterhin ignorieren könne. Van Heesch berichtet von großem Enthusiasmus innerhalb der biomolekularen und medizinischen Wissenschaftsgemeinde ob dieser neuen Erkenntnisse. Denkbar wäre zum Beispiel, „dass diese Mikroproteine unter anderem bei Herz-Kreislauf-Erkrankungen und Krebs eine Rolle spielen und als neue diagnostische und therapeutische Ziele dienen könnten“, sagt Hübner. Mehrere US-amerikanische Biotech-Unternehmen forschen bereits in diese Richtung. Und auch das Team hat große Pläne: In der jetzigen Studie wurden 281 Mikroproteine untersucht, künftig sollen die Experimente auf etliche weitere der 7000 kürzlich katalogisierten Exemplare ausgeweitet werden – mit der Hoffnung, viele noch unbekannte Funktionen aufzudecken.






















































