Neuer Stop in der zellulären Müllabfuhr von Pflanzen
Ein „Nabe und Speiche"-System ermöglicht es Pflanzenzellen, den zellulären Transport effizient zu koordinieren
Dies gilt insbesondere für den Autophagie-Prozess, die zelluläre Müllabfuhr. Spezialisierte Vesikel, die Autophagosomen, verschlingen schädliche Moleküle und transportieren sie in die Vakuole, wo sie abgebaut werden. Auf diesem Weg reifen die Autophagosomen durch molekulare Mechanismen, die in Pflanzen wenig erforscht sind. Forschende des Gregor Mendel Institut für Molekulare Pflanzenbiologie der Österreichischen Akademie der Wissenschaften (GMI) liefern neue Erkenntnisse über diese Mechanismen. Die Ergebnisse wurden im Journal of Cell Biology veröffentlicht.
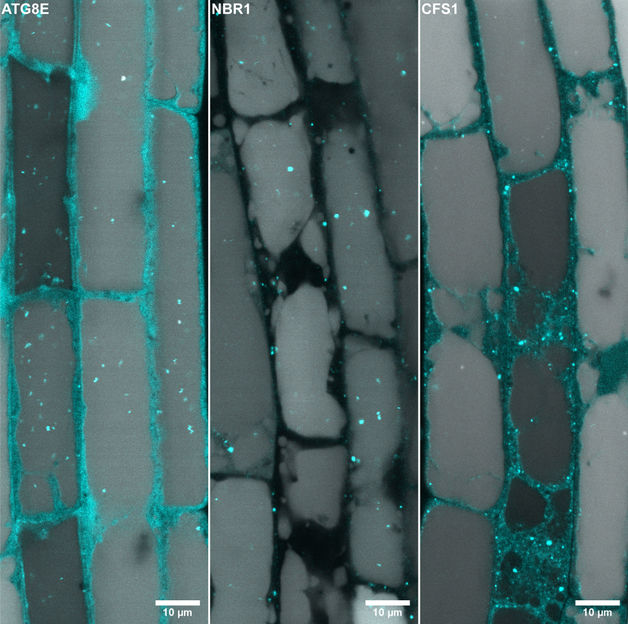
Der pflanzliche Autophagie-Adaptor CFS1 ist an der äußeren Autophagosomenmembran lokalisiert
©Dagdas/JCB/GMI
Ursprünglich war Autophagie als ein Überlebensprozess von Zellen bekannt, der startet, wenn sie ausgehungert oder unter Zellstress leiden. Zunehmend wird Autophagie jedoch als Qualitätskontrollmechanismus verstanden, der das normale Funktionieren der Zelle durch das Recycling unerwünschter oder schädlicher Zellbestandteile sicherstellt. Mit Hilfe dieser zellulären Müllabfuhr füllt die Zelle ihre molekularen Ressourcen wieder auf und erzeugt Energie. Diese Energie benötigt die Zelle, um auf Veränderungen in der Umwelt zu reagieren.
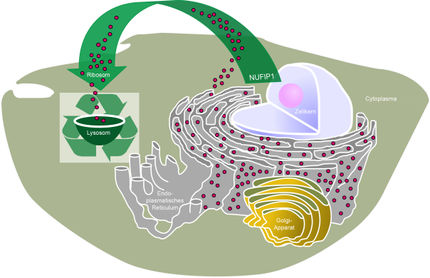
Die Autophagie funktioniert über sogenannte Autophagosomen, spezialisierte Vesikel mit Doppelmembran, die das abzubauende Material aufnehmen. „Autophagosomen sind Organellen, die geboren werden, reifen und sterben“, sagt Yasin Dagdas, Gruppenleiter am GMI und einer der korrespondierenden Autoren der Studie. „Wir wussten einiges darüber, wie Autophagosomen geboren werden, aber viel weniger über ihre Reifung und die Lieferung an ihr endgültiges Ziel, insbesondere bei Pflanzenzellen.“ In Pflanzenzellen ist das Ziel die Vakuole, eine große Organelle, die etwa 80 % des Zellvolumens ausmacht und mit Verdauungsenzymen gefüllt ist.
Viele vesikuläre Organellen, wie eben die Autophagosomen, sind in der Zelle am Werk; sie bewegen sich in einer gut orchestrierten Weise durch die Zelle, um zu reifen und ihre Funktion zu erfüllen. In ihrer jüngsten Veröffentlichung zeigen Dagdas und sein Team, dass pflanzliche Autophagosomen auf ihrem Weg zur Vakuole keinem direkten, linearen Weg folgen. „Wir wissen noch nicht, ob dies für alle pflanzlichen Autophagosomen zutrifft, aber wir zeigen, dass zumindest einige von ihnen an einem anderen Ort anhalten, bevor sie die Vakuole erreichen“, sagt Dagdas.
Mithilfe experimenteller Ansätze aus der Biochemie, der zellulären Bildgebung und der Strukturbiologie zeigen die Forschenden, dass pflanzliche Autophagosomen zunächst mit anderen Organellen, den so genannten „multivesikulären Körperchen“ (Englisch: Multivesicular Bodies, MVBs) fusionieren, um so genannte Amphisome zu bilden. Die Amphisome wiederum verschmelzen dann mit der Vakuole.
Im Mittelpunkt der neuen Erkenntnisse steht die Entdeckung des Moleküls CFS1. Dieses funktioniert als Autophagie-Adaptor, indem es Membranmarker sowohl auf den Autophagosomen als auch auf den MVBs erkennt und so deren Verschmelzung vermittelt. Die Forschenden zeigen, dass die Amphisome als zelluläre Sortierzentren für die Reifung von Autophagosomen und deren Transport in die Vakuole fungieren.
„Die Transportwege sind recht komplex, aber sie müssen alle koordiniert werden“, sagt Dagdas. „Die Erzeugung von Vesikeln ist für die Zelle energetisch kostspielig. Daher glauben wir, dass die Zelle ihre energetische Effizienz optimiert, indem sie die Amphisome als Sortierknoten für die Autophagosomen nutzt“. Die Wissenschaftler*Innen vergleichen dieses Modell der Sortierzentren mit dem System der "Nabe und Speiche", wie es in der Luftfahrtindustrie und in anderen Bereichen der Lieferkettenlogistik zu finden ist. „Indem alle Materialien über zentrale Knotenpunkte transportiert werden, senkt die Zelle ihre logistischen Kosten, da weniger Wege notwendig sind. Darüber hinaus ermöglicht dieses System der Zelle, sparsam mit ihren Ressourcen zu arbeiten, denn komplizierte Vorgänge können in den Knotenpunkten durchgeführt werden, anstatt sie in jedem Autophagosom einzeln zu organisieren“, erklärt Dagdas.
Die Forschenden bestätigten die Funktion des Autophagie-Adaptors CFS1 in zwei evolutionär weit entfernten pflanzlichen Modellorganismen: Arabidopsis thaliana und Marchantia polymorpha, was darauf hindeutet, dass dieser Mechanismus der Autophagosomenreifung bei Pflanzen konserviert ist. Die Autophagie spielt eine zentrale Rolle bei der Regulierung von Zellstress. Daher könnten diese Forschungsergebnisse in Zukunft angewendet werden, um vesikulären Pflanzenverkehr zu verbessern und so die Stresstoleranz von Pflanzen zu erhöhen.