Bakterielle Fußfessel: Bewegungshemmende Wirkstoffe gegen den Magenkeim Helicobacter pylori
Ergänzung oder Alternative zu konventionellen Antibiotikatherapien
Helicobacter pylori ist einer der am weitesten verbreiteten bakteriellen Krankheitserreger und weltweit verantwortlich für jährlich hunderttausende Fälle von Magengeschwüren und Magenkrebs. Aufgrund von zunehmenden Resistenzen des Bakteriums gegen aktuell verfügbare und therapeutisch eingesetzte Antibiotika werden dringend neue Wirkstoffe benötigt. Einer Gruppe von Wissenschaftler:innen an der Ludwig-Maximilians-Universität München (LMU) und dem Deutschen Zentrum für Infektionsforschung (DZIF) ist es gelungen, Substanzen zu identifizieren, die die Fortbewegungsfähigkeit der Bakterien hemmen und damit ihrer Vermehrung und pathogenen Aktivität vorbeugen könnten.
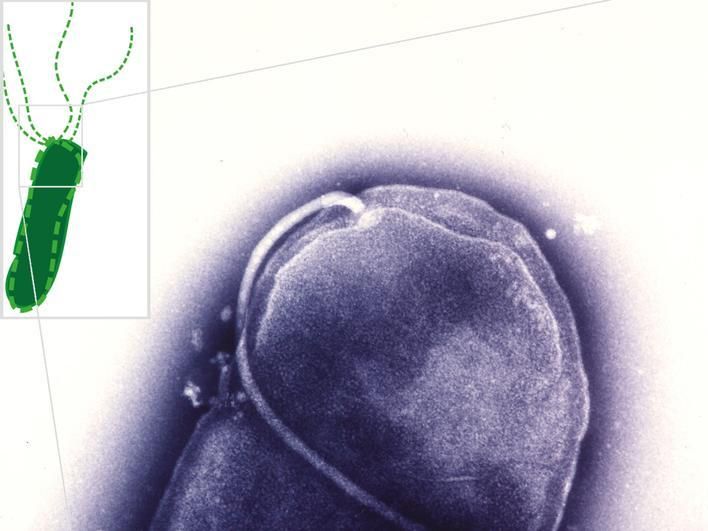
Die elektronenmikroskopische Aufnahme (violett) zeigt das Ende eines stäbchenförmigen Helicobacter pylori-Bakteriums, an dem ein Flagellum − der Propellerantrieb des Bakteriums − angeheftet ist. Bildausschnitt links oben: Schema einer ganzen bakteriellen Zelle mit Propellerflagellen. Der Aufbau sowie die Drehung des Propellers können mit den neuentdeckten Substanzen gehemmt werden.
© Christine Josenhans and Shin-Ichi Aizawa, LMU
„Die Fähigkeit, sich im zähflüssigen Milieu des Magenschleims bewegen zu können, ist für das Überleben und die Vermehrung von H. pylori essenziell“, erklärt Professorin Christine Josenhans, Wissenschaftlerin am Max von Pettenkofer-Institut der LMU und im DZIF. Diese Fähigkeit des Bakteriums machen sich die Forschenden nun zunutze, um alternative Therapien zu entwickeln.
In Zusammenarbeit mit Wissenschaftlerinnen und Wissenschaftlern am Helmholtz Zentrum für Infektionsforschung in Braunschweig, der Medizinischen Hochschule Hannover und der Berliner Charité testeten sie dazu annähernd 4.000 chemische Substanzen auf ihre mögliche Wirkung auf die Bewegungsmaschinerie der Bakterien. H. pylori trägt an einem Ende der Bakterienzelle ein Bündel von rotierenden Geißeln, die wie Schiffsschrauben agieren und die Bakterien im Magenschleim antreiben. Mit Hilfe eines speziell entwickelten Screening-Verfahrens konnten die Wissenschaftler:innen mehrere Substanzen identifizieren, die den Aufbau dieser bakteriellen Propeller hemmen und dem Bakterium quasi eine Fußfessel anlegen.
Für eine der Substanzen konnten sie in Mäusen, die mit H. pylori infiziert sind, eine starke Reduktion der bakteriellen Vermehrung im Magen beobachten, ohne dass dabei die normale bakterielle Darmflora signifikant geschädigt wurde. „Das wäre ein großer Vorteil gegenüber herkömmlichen Antibiotika, die häufig auch die unverzichtbaren „guten“ Darmbakterien dauerhaft angreifen“, erklärt Prof. Josenhans, die Letztautorin der Studie.
Für eine erfolgreiche Behandlung einer H. pylori-Infektion müssen derzeit mehrere Klassen von Antibiotika kombiniert werden, was zum Teil zu schweren Nebenwirkungen sowie weiter zunehmenden Antibiotikaresistenzen der Bakterien führt. „Die von uns Antimotiline genannten Substanzen könnten eine Ergänzung oder Alternative zu konventionellen Antibiotikatherapien darstellen und langfristig dazu beitragen, die Entwicklung von Antibiotikaresistenzen zu reduzieren“, betont Prof. Sebastian Suerbaum, Lehrstuhlinhaber für Medizinische Mikrobiologie am Max von Pettenkofer-Institut und Erstautor der Publikation.
Als nächstes soll, wie Prof. Josenhans hinzufügt, die genaue Wirkweise der aktiven Substanzen identifiziert sowie diese als neue antibakterielle Therapie weiterentwickelt werden.
Originalveröffentlichung
Sebastian Suerbaum, Nina Coombs, Lubna Patel, Dimitri Pscheniza, Katharina Rox, Christine Falk, Achim D. Gruber, Olivia Kershaw, Patrick Chhatwal, Mark Brönstrup, Ursula Bilitewski, Christine Josenhans; "Identification of antimotilins, novel inhibitors of Helicobacter pylori flagellar motility that inhibit stomach colonization in a mouse model"; mBio; 2022



















































