Neue Zielstrukturen für die Tumortherapie
Solide Tumoren bilden ab einer bestimmten Größe ein mitwachsendes Kapillarnetz von Blutgefäßen, die sie mit Sauerstoff und Nährstoffen versorgen. Ein Ansatz in der Therapie besteht darin, das Wachstum der Blutgefäße zu unterdrücken und den Tumor gewissermaßen auszuhungern. Bisher in der Klinik eingesetzte Medikamente blockieren den Gefäßwachstumsfaktor VEGF (Vascular Endothelial Growth Factor). Allerdings gibt es vermehrt Hinweise darauf, dass Tumoren diese Blockade umgehen können. Wie dies geschieht, ist unbekannt, da die Sprossung von Gefäßen (Angiogenese), bisher noch nicht im Detail verstanden ist. Prof. Amparo Acker-Palmer vom Exzellenzcluster Makromolekulare Komplexe der Goethe-Universität und ihr Ehemann, Prof. Till Acker von der Universität Gießen, haben nun einen weiteren Signalweg bei der Angiogenese entschlüsselt. Wie sie in der aktuellen Ausgabe der Fachzeitschrift „Nature“ schreiben, erschließen sich damit neue Zielstrukturen für die Krebstherapie.
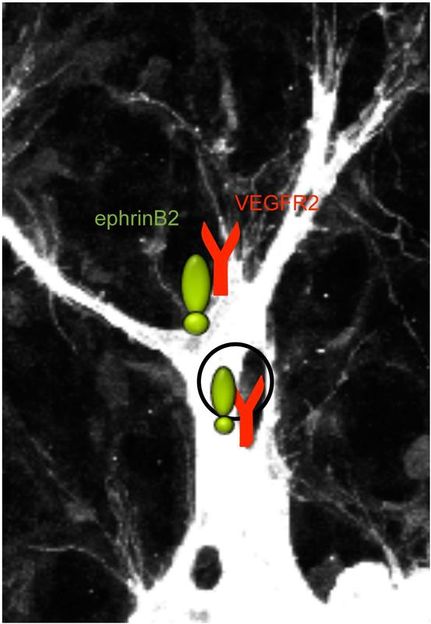
Die endothelialen„Tip “-Zellen an der Spitze eines Blutgefäßes in der Maus-Retina bilden lange Fortsätze (Filopodien) aus, mit denen sie ihre Umgebung erkunden. Für diesen Prozess muss die Zelle den Gefäßwachstumsfaktor VEGFR2 aufnehmen. Dies wird durch die Ephrin-B2-Liganden an der„Tip “-Zelle reguliert. Hier könnten auch Wirkstoffe angreifen, die das Wachstum von Blutgefäßen in Tumoren unterbinden sollen.
Amparo Acker-Palmer
Eine zentrale Rolle spielen Moleküle, die auch dafür sorgen, dass Netzwerke von Nervenzellen entstehen. Die Neurobiologin Acker-Palmer hat diese sogenannten EphrinB2-Rezeptoren im Zusammenhang mit Lernprozessen im Gehirn bereits intensiv erforscht. Für ihre Arbeiten wurde sie unlängst mit dem Paul-Ehrlich-Nachwuchspreis ausgezeichnet. Nun stellte die Forscherin fest, dass diese Rezeptoren auch in der Membran von endothelialen „Tip“ Zellen vorhanden sind – und diese sind für die Angiogenese entscheidend. Das Besondere an ihnen ist: Sie können Signale nicht nur vorwärts zu benachbarten Zellen weiterleiten, sondern auch rückwärts in das Zellinnere. Den bisher unbekannten Signalweg innerhalb der Zelle haben Amparo Acker-Palmer und der Neuropathologe Till Acker jetzt entschlüsselt.
„Wie sich herausstellte, stellt der intrazelluläre Signalweg zur Regelung des Gefäßwachstumsfaktors einen wichtigen Mechanismus bei der Angiogenese dar“, erläutert Acker-Palmer die Bedeutung ihrer Arbeit. Zum Nachweis blockierten die beiden Forscher das Ende des Rezeptors, welches Signale in das Zellinnere weiter leitet. Bei diesen Tieren war die Gefäßsprossung unterdrückt.
Offenbar reguliert Ephrin-B2 nicht nur den bisher durch Medikamente unterdrückten Gefäßwachstumsfaktor VEGFR2, sondern auch einen weiteren mit Namen VEGFR3, wie Ralf Adams und seine Mitarbeiter vom Max Planck Institut für Molekulare Biomedizin in Münster in derselben Ausgabe von Nature berichten. „Ephrin-B2 ist daher eine entscheidende Zielstruktur für Wirkstoffe, die das unerwünschte Gefäßwachstum unterbinden sollen“, erklärt Till Acker.
Originalveröffentlichung: Suphansa Sawamiphak et al.; "Ephrin-B2 regulates VEGFR2 function in developmental and tumour angiogenesis"; Nature advance online publication 5 May 2010
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Pharmaceutical Substances von Thieme Verlag
Entdecken Sie industrielle Synthesewege für 2.600 APIs
Ihr Recherchetool für Synthesen, Patente und Anwendungen – Pharmaceutical Substances

KNAUER IJM NanoScaler von KNAUER
Effiziente Formulierung von Lipid-Nanopartikeln für RNA-basierte Therapien
Optimieren Sie die Wirkstoffverkapselung von 1 ml bis zu Hunderten von Millilitern mit minimalem Wirkstoffeinsatz

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.





















































