Gefangen in einem molekularen Netz
Wissenschaftler beweisen einen neuartigen Mechanismus der Immunabwehr
Wie Zellen des Immunsystems einen Schimmelpilz davon abhalten, sich in der Lunge auszubreiten und Krankheiten zu verursachen, haben Wissenschaftler der Universitäten Magdeburg und Jena erstmals an Labormäusen zeigen können. Die Forscher konnten nachweisen, dass bestimmte Abwehrzellen - die so genannten neutrophilen Granulozyten - den Schimmelpilz Aspergillus fumigatus mit einem Netz aus DNA-Fäden zunächst umhüllen und dann zerstören.
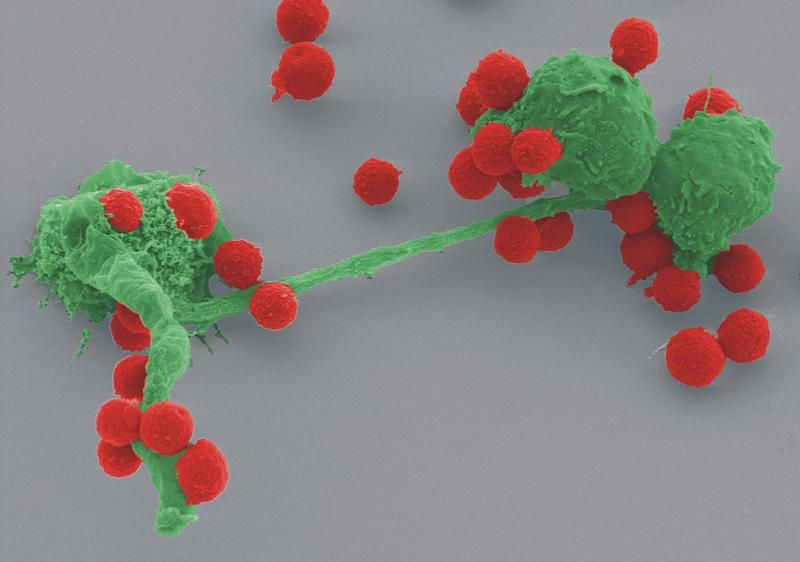
Neutrophile Granulozyten bekämpfen Sporen von Aspergillus fumigatus.
Otto-von-Guericke-Universität Magdeburg
Die Forschungsergebnisse, die langfristig zur Vermeidung von Komplikationen bei der Behandlung von Patienten mit einem geschwächten Immunsystem beitragen könnten, haben die Wissenschaftler um Professor Dr. Matthias Gunzer und Dr. Mike Hasenberg vom Institut für Molekulare und Klinische Immunologie der Otto-von-Guericke-Universität Magdeburg zusammen mit Jenaer Mikrobiologen um Professor Dr. Axel Brakhage jetzt Journal PLoS Pathogen veröffentlicht.
Aspergillus fumigatus ist ein in der Umwelt sehr häufig vorkommender Schimmelpilz, der u.a. eine maßgebliche Rolle bei der Zersetzung von Pflanzenabfällen im heimischen Kompost spielt. Für einen gesunden Menschen stellt dieser Schimmelpilz normalerweise keine Gefahr dar. Anders ist das bei Menschen mit einem stark geschwächten Immunsystem - und insbesondere dann, wenn bei diesen Menschen zu wenige oder defekte Neutrophile vorhanden sind. Das ist z.B. bei Leukämie-Patienten unmittelbar nach einer Hochdosis-Chemotherapie der Fall. Für diese Menschen besteht ein hohes Risiko, an einer von A. fumigatus ausgelösten Infektion der Lunge, die sich über den gesamten Körper ausbreiten kann, zu sterben. Auch AIDS-Patienten und Menschen, die nach einer Organtransplantation Medikamente zur Unterdrückung des körpereigenen Abwehrsystems nehmen müssen, sind durch diese Schimmelpilz-Infektion hochgradig gefährdet.
Die zugrunde liegenden zellulären und molekularen Mechanismen sind bislang erst teilweise aufgeklärt. Eine Strategie des Immunsystems besteht offenbar darin, dass Neutrophile die in das Lungengewebe eingedrungenen Schimmelpilzsporen am Wachstum hindern, indem sie ein Netz von DNA-Bausteinen aus dem Zellkern und Proteinen aus dem Zellplasma auswerfen. „Solche Hinweise gibt es seit etwa sechs Jahren“, sagt Professor Dr. Matthias Gunzer, stellvertretender Direktor des Instituts für Molekulare und Klinische Immunologie der Otto-von-Guericke-Universität Magdeburg. „Bislang konnte dieser Mechanismus der Immunabwehr aber nur in-vitro, also nur an außerhalb des Körpers kultivierten Zellen des Lungengewebes, nachgewiesen werden. Es schien möglich, dass es sich nur um ein außergewöhnliches Verhalten der ihrer natürlichen Umgebung beraubten Zellen handelte“, sagt der Wissenschaftler. Das konnten die Magdeburger Forscher zusammen mit Kollegen aus Jena jetzt eindeutig ausschließen.
Weltweit gelang es ihnen erstmals, den Vorgang der Eindämmung von invasivem Pilzwachstum im Lungengewebe mit modernsten Verfahren der in-vivo Video-Mikroskopie und mit Zellfärbetechniken darzustellen. Sie konnten zeigen, dass innerhalb weniger Stunden nach Inhalation der Schimmelpilzsporen der Angriff der neutrophilen Granulozyten auf die Eindringlinge beginnt. Sie lagern sich an die Pilzfragmente an und hindern A. fumigatus an der weiteren Ausbreitung, indem sie ihre Zellmembran auflösen und die im Zellkern vorhandene DNA explosionsartig freisetzen. „Das Fangnetz aus klebrigen DNA-Fäden stoppt zunächst die Ausbreitung von Aspergillus und zerlegt die eingefangenen Sporen dann in unschädliche molekulare Bausteine“, so Dr. Mike Hasenberg der die Untersuchungen in Magdeburg durchgeführt hat. Kollegen aus Jena konnten dabei zeigen, dass A. fumigatus mit einer Tarnkappe aus dem Biomolekül RodA das Fangnetz zu durchschlüpfen versucht, indem er für die Neutrophilen quasi unsichtbar wird. Im gesunden Lungengewebe gelingt das den Eindringlingen nur kurze Zeit. Der infizierte Organismus kann den Pilz spätestens beim Versuch auszukeimen erkennen und dann erfolgreich zerstören. „Im Verlauf der Evolution hat sich offenbar eine Art Gleichgewicht der biochemischen Waffen herausgebildet“, mutmaßt Professor Gunzer. „Gefährlich wird es für einen Menschen erst dann, wenn die Kräfte des körpereigenen Abwehrsystems nachlassen.“
Untersuchungen anderer Forschergruppen weisen darauf hin, dass die neutrophilen Granulozyten ihre molekularen Fangnetze auch auf andere Krankheitserreger und in anderen Organen, beispielsweise dem Blinddarm und in den Nieren, werfen. Manche Erreger haben gelernt, Lücken in das DNA-Verteidigungsnetz zu schneiden. Ein Beispiel dafür sind die Pneumokokken, die oftmals lebensbedrohliche Lungenentzündungen bei älteren Menschen und Patienten mit schwachem Immunsystem hervorrufen können. „Schon seit längerem ist bekannt, dass sie ein Enzym bilden, dass die DNA, welche außerhalb von Zellen vorkommt, abbauen kann“, so Professor Gunzer. „Erst jetzt, durch die aktuellen Forschungen an dem speziellen Immun-Abwehrmechanismus, wird verständlich, welchen Zweck dieses Enzym hat, nämlich die Zerschneidung der freigesetzten DNA-Fangnetze.“ So fügt sich langsam ein Baustein im Verständnis des Immunsystems zum anderen.
Trotz aller Freude über den Forschungserfolg wäre es ein Irrtum anzunehmen, dass die DNA-Fangnetze die alleinige körpereigene Front im Kampf gegen Pilzsporen darstellen, schlussfolgern die Forscher im Wissenschaftsjournal PLoS Pathogens. Wahrscheinlich gibt es zahlreiche, gestaffelte Abwehrstrategien des Immunsystems. Dennoch könnte die weitere Aufklärung dieser besonderen Art der körpereigenen Verteidigung in Zukunft vielleicht zu völlig neuen Therapieansätzen auf ganz unterschiedlichen Gebieten der Klinik führen, hoffen die an den Untersuchungen beteiligten Wissenschaftler.
Originalveröffentlichung: Sandra Bruns, Olaf Kniemeyer, Mike Hasenberg et al.; "Production of Extracellular Traps against Aspergillus fumigatus In Vitro and in Infected Lung Tissue Is Dependent on Invading Neutrophils and Influenced by Hydrophobin RodA"; PLoS Pathogens 2010