Reparaturmechanismus von Tumorzellen gezielt ausschalten
Neue Erkenntnisse für die Entwicklung neuer oder die Verbesserung bestehender Krebstherapien
Mutationen in den Genen BRCA1 und BRCA2 – auch bekannt als „Brustkrebs-Gene“ – stehen im Zusammenhang mit erblich bedingtem Brustkrebs und anderen Krebserkrankungen. Ein Forschungsteam der TU Darmstadt, der University of California und der University of Texas hat Reparaturprozesse in BRCA2-mutierten Tumorzellen untersucht und konnte neue Erkenntnisse für die Entwicklung neuer oder die Verbesserung bestehender Krebstherapien gewinnen. Die Ergebnisse wurden im Wissenschaftsmagazin Nature Cell Biologie (NCB) veröffentlicht.
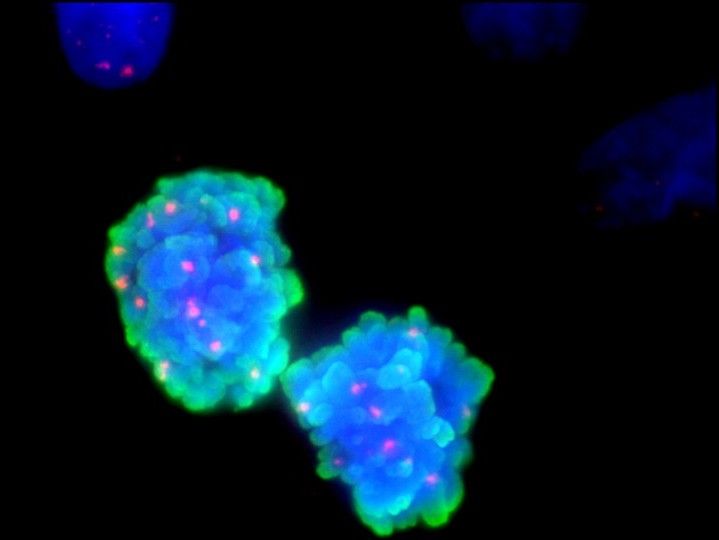
DNA-Doppelstrangbrüche während der Zellteilung. Dargestellt sind zwei sich teilende BRCA2-mutierte Zellen, in denen der TMEJ-Reparaturprozess ausgeschaltet wurde. Diese weisen zahlreiche unreparierte Doppelstrangbrüche auf (erkennbar als rote Punkte), welche in Zellen mit funktionalem BRCA2 fast gar nicht nachweisbar sind und zum Absterben der Zellen führen können. Angefärbt wurden die DNA (blau), der Mitose-Marker pH3 (grün) und der DSB-Marker yH2AX (rot).
Michael Ensminger
Unsere Erbinformation ist in der DNA gespeichert, die in jeder Zelle des Körpers vorhanden ist. Durch verschiedene innere und äußere Einflüsse kommt es täglich zu zahlreichen Schädigungen der DNA. Diese werden normalerweise von der Reparaturmaschinerie unseres Körpers behoben. Ist diese gestört, kann Krebs entstehen.
Der schwerwiegendste DNA-Schaden ist der so genannte Doppelstrangbruch, bei dem das DNA-Molekül komplett durchtrennt ist. Bereits ein Doppelstrangbruch kann zum Absterben der Zelle führen, wenn er unrepariert verbleibt oder fehlerhaft repariert wird. Einer der beiden Hauptmechanismen der Zelle zur Reparatur von Doppelstrangbrüchen ist die Homologe Rekombination. Dafür sind die Gene BRCA1 und BRCA2 essentiell. Sind diese Gene in einem Tumor mutiert, ist dessen DNA-Reparaturmechanismus gestört.
Gezieltes Hervorrufen von Doppelstrangbrüchen in Krebszellen
Im Rahmen einer Krebsbehandlung werden durch Chemotherapie oder Strahlentherapie gezielt Doppelstrangbrüche in den Krebszellen erzeugt, um diese dadurch möglichst vollständig abzutöten. BRCA2-mutierte Zellen können nun jedoch nicht den „üblichen“ Weg der Homologen Rekombination nutzen, um Doppelstrangbrüche zu reparieren, sondern sind auf alternative Reparaturmechanismen angewiesen. Ein vielversprechender, neuer Ansatz für die Therapie BRCA2-mutierter Tumore könnte darin bestehen, diese alternativen Mechanismen gezielt zu hemmen. Da BRCA2 nur in den Tumorzellen mutiert ist, hätte dieser Ansatz den großen Vorteil, dass die Tumorzellen gezielt abgetötet würden. Die gesunden Zellen wären davon aber nicht betroffen, da diese noch über ein funktionales BRCA2-Gen verfügen und Doppelstrangbrüche somit über den Weg der Homologen Rekombination beheben können. Leider sind die in BRCA2-mutierten Zellen ablaufenden alternativen Reparaturmechanismen für eine gezielte Hemmung momentan aber noch nicht genau genug verstanden.
Neue Erkenntnisse über Reperaturmechanismen
Einen speziellen alternativen Reparaturmechanismus in BRCA2-mutierten Zellen hat die Arbeitsgruppe von Professor Markus Löbrich an der TU Darmstadt im Rahmen einer Studie untersucht, die soeben im renommierten Wissenschaftsmagazin Nature Cell Biology veröffentlicht wurde. In dieser Studie, an der auch Arbeitsgruppen der University of California und der University of Texas beteiligt waren, konnte mit dem so genannten POLθ-mediated end-joining (TMEJ) ein Reparaturmechanismus identifiziert werden, der für die Doppelstrangbruch-Reparatur in BRCA2-mutierten Zellen hauptverantwortlich ist.
Wird dieser Prozess gezielt ausgeschaltet, verbleiben Doppelstrangbrüche in BRCA2-mutierten Zellen unrepariert, was zum Absterben der Krebszellen führt. Darüber hinaus konnten die Forschenden zwei Faktoren identifizieren, welche den TMEJ-Prozess regulieren, nämlich RAD52 und BRCA2 selbst. Wird RAD52 nun in BRCA2-mutierten Zellen ausgeschaltet, läuft der TMEJ-Weg fehlerhaft ab, wobei es zur Ausbildung von Fusionen zwischen verschiedenen Chromosomen kommt, die ebenfalls zum Zellsterben beitragen.



















































