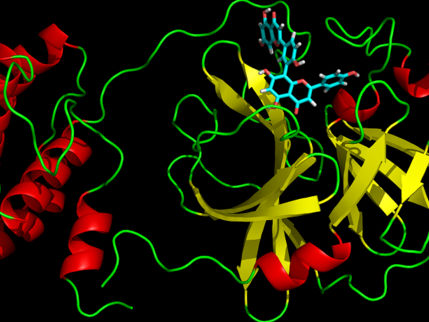
Immunität gegen SARS-CoV-2: Andockstelle des Spikeproteins ist die Achillesferse des Virus
Diese Andockstelle ändert sich auch bei Virusmutanten nicht wesentlich
Rund zwanzig Prozent von an Covid-19 genesenen Menschen entwickeln keinen Immunschutz gegen SARS-CoV-2. Zu diesem Resultat kam ein Forschungsteam der MedUni Wien um den Allergologen und Immunologen Rudolf Valenta vom Zentrum für Pathophysiologie, Infektiologie und Immunologie. Es zeigte sich in einer Studie, dass der entscheidende Immunschutz, der das Andocken und Eindringen in die Körperzellen verhindert, nur dann entsteht, wenn man Antikörper speziell gegen die gefaltete Rezeptorbindungsdomäne (RBD) des Spikeproteins bilden kann. Diese Andockstelle ändert sich auch bei Virusmutanten nicht wesentlich. Manchen Menschen ist das jedoch aus unterschiedlichen Ursachen nicht möglich. Abhilfe könnte ein Antigen-basierter, auf RBD abzielender Impfstoff schaffen, der aber noch nicht zur Verfügung steht.
Symbolbild
pixabay.com
Vor einem Jahr untersuchte ein Forschungsteam um den Studienleiter Rudolf Valenta und Winfried F. Pickl vom Zentrum für Pathophysiologie, Infektiologie und Immunologie der MedUni Wien anhand einer ersten Kohorte genesener COVID-19-Patienten mit mildem Krankheitsverlauf den Status ihrer Immunität. Damals zeigte sich unter anderem, dass ein beträchtlicher Teil der Infizierten keine schützenden Antikörper gegen SARS-CoV-2 bilden konnte.
In der nun publizierten Folgestudie analysierten Valenta und sein Team die Antikörperantwort einer größeren Kohorte nach milder und schwerer SARS-CoV-2 Infektion. Die Studie erfolgte mit Hilfe der an der MedUni Wien entwickelten Mikroarray (Chip)-Technologie, wobei eine Vielzahl an Virus-Antigenen auf einen Chip in mikroskopischer Größe maschinell aufgebracht werden. Zusätzlich wurden überlappende Eiweißbruchstücke (Peptide) dieser Virusantigene darauf fixiert, die das ganze Spikeprotein abdecken, auf dem die Rezeptorbindungsdomäne (RBD) sitzt. Mit dieser bindet das SARS-CoV-2-Virus an den ACE2-Rezeptor der menschlichen Zellen.
Die Erwartung der Forscher war, dass eine Immunreaktion auf die Peptide erfolgen würde, jedoch kam es nur gegenüber dem intakten, dreidimensional gefalteten Spikeprotein zu Antikörperbildung. Proteine erhalten ihre dreidimensionale Gestalt nämlich durch den physikalisch bedingten Prozess der Eiweiß-Faltung. Das SARS-CoV-2-Virus benötigt zum Andocken an die Körperzellen offenbar das dreidimensional gefaltete Protein. Ausschließlich eine Antikörper-Antwort gegen das gefaltete Protein, nicht aber gegen Teile davon, schützt gegen die Infektion.
Daraus ergibt sich eine wesentliche Schlussfolgerung: Hohe Antikörperspiegel gegen das gefaltete Spikeprotein und insbesondere gegen die darin enthaltene RBD verhindern die Bindung des Virus an die menschlichen Körperzellen. Wenn jemand jedoch keine Antikörper gegen die gefaltete RBD bilden kann, ist er wenig geschützt. Die Forscher zeigten auch, dass nur die gefaltete RBD, nicht aber ungefaltete RBD bei Immunisierung einen Immunschutz erzeugt. Da die derzeit in Verwendung stehenden genetischen Impfstoffe eine Infektion nachahmen, ist es daher möglich, dass Impfdurchbrüche durch mangelnde Entwicklung von Antikörpern gegen gefaltetes RBD erklärbar sind.
Zusammenfassend lässt sich somit festhalten, dass Menschen, die in ausreichender Menge Antikörper gegen die gefaltete RBD bilden, gegen SARS-CoV-2 Infektionen geschützt sind. Diese Antikörper sind im Blut durch Neutralisationstests gut messbar. Leider funktioniert die Produktion dieser Antikörper bei zwanzig Prozent der Genesenen - und wahrscheinlich auch Geimpften - nicht. Valenta: „Die Entwicklung eines mittels Helfer-Eiweißes verstärkten, auf RBD basierenden Antigen-Impfstoffes ist dringend erforderlich. Dieser würde in großer Effektivität RBD-spezifische und damit neutralisierende Antikörper induzieren, deren Spiegel durch Auffrischungsimpfungen hochgehalten werden könnte.“ So ließe sich auch die „Achillesferse“ des Virus ausnützen, dessen Andockstelle sich bei Mutationen nicht wesentlich ändere, so Valenta weiters.