Eine neue Ära der Genomsequenzierung
16 neue hochqualitative Referenzgenome von Wirbeltieren
Das internationale Vertebrate Genomes Project (VGP) veröffentlicht seine Flaggschiff-Studie die sich mit der Qualität und Standardisierung von Genomassemblierungen beschäftigt, zusammen mit 20 dazugehörigen Publikationen. In dieser Studie werden 16 diploide, hochqualitative, nahezu fehlerfreie und fast vollständige Referenzgenome von Wirbeltieren beschrieben, die das Ergebnis der fünfjährigen Pilotphase des VGP-Projekts sind. Auf der Grundlage der Genome aller Wirbeltiere besteht nun die Möglichkeit, zu untersuchen, wie Gene zur Evolution und zum Überleben dieser Arten beigetragen haben und damit offene Fragen zu menschlichen Krankheiten beantwortet werden könnten. Der überwiegende Teil der Genomdaten wurde an drei Sequenzierzentren erstellt, darunter das Rockefeller University Vertebrate Genome Lab in New York, USA (teilweise unterstützt durch das Howard Hughes Medical Institute), das Wellcome Sanger Institute in Großbritannien, und das Max-Planck-Institut für molekulare Zellbiologie und Genetik in Dresden.

Symbolbild
pixabay.com
Entstanden aus der zehn Jahre alten Mission der "Genome 10K Community of Scientists (G10K)", die Genome von 10.000 Wirbeltierarten zu sequenzieren, und anderen vergleichenden Genomforschungsprojekten ist es das Ziel des VGP, nahezu fehlerfreie Referenzgenome von allen 71.000 existierenden Wirbeltierarten zu erstellen. Referenzgenome sind jeweils ein Beispielgenom einer Art und liefern eine Karte der DNA-Sequenz einer Spezies und ihres räumlichen Kontexts, also wo entlang der Chromosomen ein bestimmtes Stück der DNA-Sequenz zu finden ist. Diese Genome sollen helfen, grundlegende Fragen der Biologie, der Biodiversität, und menschlicher Krankheiten zu beantworten. Außerdem sollen die Arten identifiziert und sequenziert werden, die vom Aussterben bedroht sind, und so ihre genetischen Informationen für zukünftige Generationen bewahrt werden. Die hochqualitativen VGP-Genome sollen in Zukunft zu den wichtigsten Referenzquellen für Spezies werden. In einer digitalen Bibliothek für Genome, der „Genom-Arche“, werden diese dann gespeichert und öffentlich zugänglich.
In der Vergangenheit war die Erstellung von Referenzgenomsequenzen teuer und arbeitsintensiv, sodass sie nur für den Menschen und die wichtigsten Modellorganismen erstellt wurden. Diese Genome enthielten immer noch Lücken und Fehler. Für ein vollständiges Verstehen evolutionärer Prozesse und anderer grundlegender Fragen in der Biologie werden jedoch qualitativ hochwertige Referenzgenome benötigt. Adam Phillippy, Vorsitzender der VGP-Genomassemblierungs- und Informatik-Arbeitsgruppe mit über 100 Mitgliedern und Leiter der Genom-Informatik-Abteilung des National Human Genome Research Institute, National Institutes of Health, Bethesda, Maryland, USA, sagt: „Die Fertigstellung des ersten Wirbeltier-Referenzgenoms, des Menschen, dauerte über 10 Jahre und kostete 3 Milliarden Dollar. Dank der fortlaufenden Forschung und der Investitionen in die DNA-Sequenzierungstechnologie in den letzten 20 Jahren können wir diese erstaunliche Leistung jetzt mehrmals täglich für nur wenige tausend Dollar pro Genom wiederholen.“
Beteiligung von Max-Planck-Instituten am VGP
Einer der Standorte für die Sequenzierung ist das Max-Planck-Institut für molekulare Zellbiologie und Genetik in Dresden. Gene Myers, Leiter des VGP-Sequenzier-Hubs am Max-Planck-Institut und am Zentrum für Systembiologie Dresden, sagt: „Das VGP-Projekt steht an der Spitze der Erstellung eines Katalogs von Genomen in Analogie zu Linnaeus' Klassifizierung des Lebens. Ich und meine Kollegen in Dresden sind begeistert, dass wir mit der finanziellen Unterstützung der Max-Planck-Gesellschaft Deutschland solche hervorragenden Genom-Rekonstruktionen beisteuern können.“ Die Dresdner Wissenschaftler sind Teil des DRESDEN-concept Genome Center und verfügen über besondere Expertise beim Einsatz verschiedener „long-read“ Sequenzierungstechnologien. Längere Sequenzstücke sind wichtig, da sie komplexe und sich wiederholende Teile im Genom auflösen und überspannen können und damit eindeutige Zuordnungen erlauben. Das Dresdner Hub hat zu drei der 16 veröffentlichten Genome beigetragen: zur Großen Hufeisennase (Rhinolophus ferrumequinum), dem Buntbarsch (Archocentrus centrarchus) und dem Genom der Kleinen Lanzennase (Phyllostomus discolor). Die ersten beiden Genome wurden vollständig vom Dresdner Hub erarbeitet, und für P. discolor wurden die Genomdaten am Rockefeller Hub und die Assemblierung und die transkriptomischen Daten in Dresden erstellt.
Die Gewebeproben der Fledermäuse wurden von Mitgliedern des Bat1K-Konsortiums unter der Leitung von Sonja Vernes vom Max-Planck-Institut für Psycholinguistik in den Niederlanden und der University of St Andrews, UK, und Emma Teeling vom University College Dublin zur Verfügung gestellt. Das Bat1K-Konsortium hat sich zum Ziel gesetzt, alle lebenden Fledermausarten zu sequenzieren und war maßgeblich an der Sequenzierung und Analyse von Fledermausgenomen in Zusammenarbeit und als Partner des Gesamtprojekts VGP beteiligt. Die Gewebeproben der Fliegerbuntbarsche stammen von Axel Meyer, Universität Konstanz, Deutschland.
Robert Kraus vom Max-Planck-Instituts für Verhaltensbiologie in Konstanz, Deutschland, trug schon früh dazu bei, Ideen und Visionen für die Mission des VGP zu entwickeln und setzte den Fokus dabei auf weniger Genome, aber höhere Qualität für jedes Genom. Robert Kraus sequenzierte auch mehrere Vogelarten, um die Ursachen für die Immunantwort der Vogelgrippe zu untersuchen. Diese Genome sind noch im Hintergrund des VGP und werden Teil der nächsten Veröffentlichungen sein.
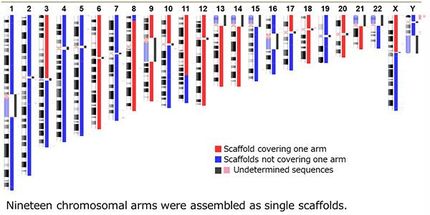
Sequenzierte Spezies
Die exzellente Qualität dieser Genome ermöglicht neue Erkenntnisse in noch nie dagewesenem Ausmaß für die Charakterisierung der Artenvielfalt für alles Leben, den Artenerhalt und die menschliche Gesundheit. Die ersten hochqualitativen Referenzgenome von sechs Fledermausarten, die im Bat 1K-Konsortium erstellt wurden, zeigten die Auslese und den Verlust von Genen im Zusammenhang mit dem Immunsystem, die möglicherweise die besondere Toleranz von Fledermäusen gegenüber Virusinfektionen erklären könnten. Damit könnte auch die erhöhte Überlebensfähigkeit erklärt werden, die insbesondere für neu auftretende Infektionskrankheiten wie die aktuelle COVID-19-Pandemie von Bedeutung sind.
Sonja Vernes, eine Gründungsdirektorin des Bat1K-Konsortiums und UKRI Future Leaders Fellow, sagte: „Diese neuen Genome sind ein großer Schritt zur Beantwortung wichtiger Fragen zur Biologie und Evolution bei Wirbeltieren. Wir können bereits jetzt spannende neue Merkmale der Evolution von Chromosomen erkennen, einschließlich der Veränderungen, die in den sechs vom Bat1K-Konsortium bereitgestellten Fledermausarten gefunden wurden und die möglicherweise zu einem verbesserten Immunsystem und einer Toleranz gegenüber Krankheitserregern beitragen. In Zukunft werden uns diese Genome auch helfen, komplexe Verhaltensweisen zu verstehen, wie die Evolution der tierischen Kommunikation und wie sich die menschliche Sprache entwickelt hat.“
Analysen der VGP-Genome des Kakapo, eines flugunfähigen Papageis, der in Neuseeland endemisch ist, und des Vaquita, eines kleinen Schweinswals und des am stärksten gefährdeten Meeressäugers im Golf von Mexiko, deuten auf evolutionäre und demografische Entwicklungen hin, bei denen schädliche Mutationen in freier Wildbahn beseitigt wurden.
Eine neue Ära in der Genomforschung durch Kooperationen
Dieses umfangreiche vergleichende Genomprojekt stellt eine neue Ära in der Genomforschung dar, indem es neuartige Pipelines für hochmoderne und konsistente Sequenzierungs-, Assemblierungs- und Annotationstechniken entwickelt und einsetzt. Diese können helfen, grundlegende Fragen der vergleichenden Biologie, Genetik, Biodiversität, Artenerhaltung und Gesundheit in Zukunft zu beantworten. Das Projekt dient auch als Modell für wissenschaftlichen Kooperationen, vor allem für weitere groß angelegte Genomprojekte. Beispielhaft sind die umfangreiche Infrastruktur sowie die erfolgreiche Zusammenarbeit von Hunderten internationalen Wissenschaftlern aus mehr als 50 Institutionen in 12 verschiedenen Ländern, seit das VGP im Jahr 2016 initiiert wurde.
Im nächsten Schritt wird das VGP die weltweite Zusammenarbeit mit anderen Konsortien fortsetzen, um Phase 1 des Projekts abzuschließen, dessen Ziel die Sequenzierung jeweils einer repräsentativen Art aus den 260 Ordnungen der Wirbeltiere ist. Technologische Fortschritte, verbesserte Berechnungsmethoden und die ständig sinkenden Sequenzierungskosten ermöglichen es dem VGP, das ehrgeizige Ziel zu verfolgen, ein Referenzgenom für jede existierende Wirbeltierart der Erde zu erstellen. In der ersten Phase des Projekts konzentriert sich das VGP auf Verbesserung von Genomsequenzierungs- und Assemblierungsansätzen sowie Erstellung von 260 hochwertigen Genomen von Arten, die alle Wirbeltierordnungen repräsentieren. Das VGP wird weiterhin weltweit aktiv sein und mit anderen Konsortien zusammenarbeiten, um Phase 1 des Projekts abzuschließen. Phase 2 wird repräsentativen Arten aus jeder Wirbeltierfamilie beinhalten. Zurzeit werden die zu sequenzierenden Tierarten identifiziert und Mittel zur Finanzierung beschafft. Das VGP hat eine Politik der offenen Tür und heißt weitere Kollaborationspartner willkommen, sich diesem Projekt anzuschließen, angefangen von der Mittelbeschaffung über die Probensammlung bis hin zur Erstellung von Genomassemblierungen oder man kann seine eigenen Genomassemblierungen einbringen, die die VGP-Metriken als Teil der Gesamtmission erfüllen.