High Speed-Modell für den Kampf gegen Corona
Forschende entwickeln genetisch veränderte Mäuse für die Coronaforschung
Bevor Therapien gegen Sars-CoV am Menschen getestet und allgemein zugänglich gemacht werden, muss ihre Wirkung an Tieren untersucht und optimiert werden. Die Maus ist ein in der Medizin häufig eingesetzter Modellorganismus. Da sich Rezeptormoleküle zwischen Menschen und Mäusen so stark unterscheiden, dass Sars-CoV2 nicht in die Zellen der Tiere eindringen können, konnte die Infektion an Mäusen bisher nicht untersucht werden. Hans Schöler vom Max-Planck-Institut für molekulare Biomedizin in Münster hat zusammen mit Kollegen aus China Mäuse genetisch so verändert, dass sie den humanen ACE2-Rezeptor auf ihren Körperzellen bilden. Dafür verwendeten die Forscher ein Verfahren aus der Stammzellforschung. An den Tieren testen nun Forschende neue Therapien gegen das Corona-Virus. Aber auch für andere Erreger könnte mit dieser Technologie schnell ein geeignetes Modell für eine Infektion geschaffen werden.
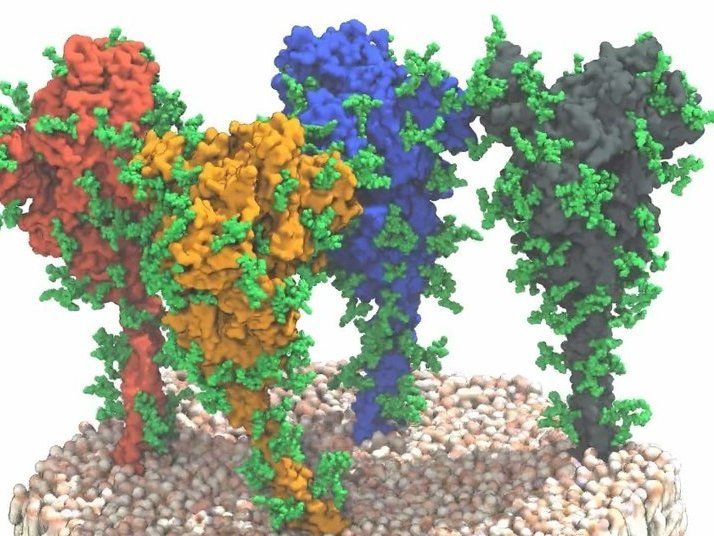
Vier Spike-Proteine auf der Membranoberfläche von Sars-CoV-2. Docken diese Proteine an ACE2-Rezeptoren auf der Oberfläche von Körperzellen an, kann das Virus in die Zellen eindringen und sich dort vermehren.
© MPI f. Biophysik/ von Bülow, Sikora, Hummer
Um das Coronavirus Sars-CoV2 einzudämmen und die Zunahme an Infektionen und Todesfällen zu verlangsamen, arbeiten Forscher und Mediziner weltweit an der schnellen Entwicklung von Impfstoffen und Medikamenten. Bevor Medikamente in klinischen Phasen am Menschen erprobt werden können, müssen sie an Tieren genau untersucht werden. Mäuse bieten sich dabei als Modellorganismen an: Sie sind klein und vermehren sich schnell. Außerdem gibt es gut untersuchte Inzuchtstämme, bei denen alle Tiere genetisch nahezu identisch und so gut miteinander vergleichbar sind.
Damit das Coronavirus in menschliche Zellen eindringen kann, benötigt es ein Rezeptormolekül. Dieses funktioniert nach dem Schlüssel-Schloss-Prinzip: Der Schlüssel des Virus, ein Protein seiner Hülle, dockt an das Schloss in Form des sogenannten ACE2-Rezeptors des Menschen an. In die Körperzellen von Mäusen kann Sars-CoV2 über die ACE2-Rezeptoren der Tiere jedoch nicht eindringen, denn der Schlüssel passt nicht zum Schloss. Der Schlüssel – das Virusprotein – kann zwar nicht geändert werden, wohl aber das Schloss. Wenn also der humane ACE2-Rezeptor in das Mäuse-Erbgut eingebracht würde, ließe sich der Verlauf und die Behandlung einer Sars-CoV2-Infektion auch in den Nagern untersuchen.
Mäuse mit Rezeptorvariante des Menschen
In einem Kooperationsprojekt von Hans Schöler vom Max-Planck-Institut für molekulare Biomedizin in Münster mit Kollegen aus China ist es gelungen, Mäuse genetisch so zu verändern, dass sie den humanen ACE2-Rezeptor auf ihren Zellen tragen. Dafür haben die Wissenschaftler eine Technologie aus der Stammzellforschung verwendet: Bei der sogenannten tetraploiden Komplementierung verschmelzen Forschende die Zellen eines zweizelligen Spenderembryos. Da normalerweise Zellen jeweils zwei Kopien eines Chromosoms enthalten, entstehen durch die Fusion Zellen mit vierfachem Chromosomensatz. Diese tetraploiden Zellen können keinen lebenden Embryo mehr bilden, sondern entwickeln sich ausschließlich zur zellulären Hüllschicht, aus der später Plazenta und Nabelschnur entstehen. Gibt man zwischen die tetraploiden Zellen embryonale Stammzellen, so entwickelt sich aus den Stammzellen der eigentliche, lebensfähige Embryo.
Mit der Genschere CRISPR-Cas9 hat das chinesisch-deutsche Team den humanen ACE2-Rezeptor (hACE2) in embryonale Stammzellen von Mäusen eingebracht. Mit der tetraploiden Komplementierung entwickelten sich aus diesen genetisch veränderten Stammzellen Mäuseembryonen, die den Rezeptor auf ähnliche Weise wie der Mensch bilden. Die Forschenden konnten das Virus in den genetisch veränderten Mäusen nach einer Infektion mit Sars-CoV2 unter anderem in Lunge und Atemwegen nachweisen. „Die Erkrankung verläuft bei den Tieren ähnlich wie Covid-19 beim Menschen“, sagt Hans Schöler. So kann eine Infektion auch bei den Mäusen ein akutes Atemnotsyndrom und Lungenschäden verursachen. Wurden die Mäuse mit neutralisierenden Antikörpern behandelt, unterdrückte dies wie beim Menschen die Virusvermehrung in Lunge und Atemwegen. „Unsere Mäuse sind also ein gutes Modellsystem, um zum Beispiel die Wirkung neutralisierende Antikörper oder von Medikamenten gegen das Corona-Virus zu untersuchen“, erklärt Schöler.
Genetisch veränderte Mäuse in Rekordzeit
Dank der neuen Technik haben die Forschenden die genetisch veränderten hACE2-Mäuse in Rekordzeit entwickelt. Andere Verfahren, wie etwa die Injektion von embryonalen Stammzellen in Blastozysten dauern je nach Zuchterfolg etliche Monate, bis man die ersten transgenen Mäuse einsetzen kann. Der sogenannte Kerntransfer ist zwar ähnlich schnell wie die tetraploide Komplementierung, ist aber technisch äußerst kompliziert. Die Chromosomen müssen nämlich mit einer dünnen Kanüle einer Spendereizelle entfernt und dann das genetisch veränderte Erbgut in die Eizelle eingebracht werden. Zudem ist die Erfolgsquote entsprechend äußerst gering. „Die tetraploide Komplementierung ist dagegen vergleichsweise einfach“, so Schöler. „Dadurch ist es möglich, in nur 35 Tagen ganz unterschiedliche Mausmodelle für die Infektion mit Sars-CoV2 zu etablieren.“
Besonders hilfreich ist, dass sich Gene in den embryonalen Stammzellen sehr effizient verändern und untersuchen lassen, bevor man sie in der tetraploiden Komplementierung einsetzt. „Das verringert nicht nur den Zeitaufwand von vielen Monaten auf wenige Wochen, sondern auch die Zahl der dafür notwendigen Mäuse ungemein“, so Schöler. Das ist einerseits während der derzeitigen Pandemie sehr wichtig, aber auch in Zukunft könnten diese Technologien helfen, schnell auf die Bedrohung durch neue Erreger zu reagieren.
Originalveröffentlichung
Feng-Liang Liu, Kaixin Wu, Jiaoyang Sun, Zilei Duan, Xiongzhi Quan, Junqi Kuang, Shilong Chu, Wei Pang, Han Gao, Ling Xu, Ying-Chang Li, Hai-Lin Zhang, Xue-Hui Wang, Rong-Hua Luo, Xiao-Li Feng, Hans R Schöler, Xinwen Chen, Duanqing Pei, Guangming Wu, Yong-Tang Zheng, Jiekai Chen; "Rapid generation of ACE2 humanized inbred mouse model for COVID-19 with tetraploid complementation"; National Science Review; 24 November 2020