Nützliche „Fake“-Peptide
Oligoharnstoff-Foldamere binden in peptidartiger Helixstruktur an Zielproteine
Einige nützliche Medikamente bestehen aus Peptiden, die gezielt an bestimmte Zellproteine binden. Um solche Wirkstoffe wirksamer und stabiler zu machen, haben Wissenschaftler jetzt eine Möglichkeit gefunden, ganze Abschnitte des Peptids mit Ureido-(Harnstoff-)Einheiten zu ersetzen. Solche Oligoharnstoff-Abschnitte falten sich ähnlich wie Peptide. Diese „Fake“-Peptide erleichtern ein systematisches Medikamentendesign, so das Fazit der in der Zeitschrift Angewandte Chemie veröffentlichten Studie.
© Wiley-VCH
Manche Medikamente sind Peptide, die bestimmte Proteine in der Zelle hemmen oder aktivieren. Um die Peptide noch leistungsfähiger zu machen, untersuchen Wissenschaftler hybride Peptid-Mimetika. Diese synthetischen Moleküle bestehen aus Strängen kleiner, aminosäureähnlicher organischer Einheiten. Da proteolytische Enzyme solche Fake-Peptidstränge weniger angreifen, sollten die Medikamente wirksamer werden.
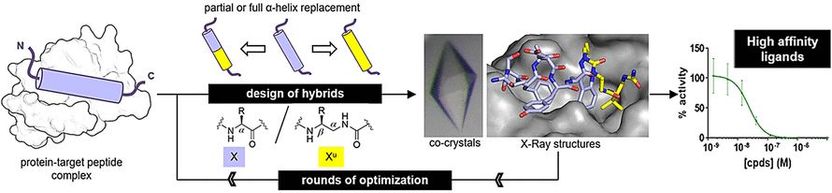
Die synthetischen Stränge – Oligomere genannt – müssen sich jedoch in die Struktur des Original-Peptids falten, um sauber an ihr Zielprotein zu binden. Gilles Guichard und sein Team am CNRS, Universität Bordeaux, und Kollegen von der Universität Straßburg und Ureka Pharma in Mulhouse haben dafür Oligomere aus Einheiten auf Harnstoffbasis untersucht. Oligoharnstoff-Stränge falten sich zu Helices, wie sie bei Peptiden typisch sind. Es gibt aber leichte Unterschiede. „Pro Umdrehung sind in Oligoharnstoff-Helices weniger Reste vorhanden, die Ganghöhe ist kleiner, und der Durchmesser ist größer als die Peptid-Alpha-Helix“, erklärt Guichard.
Um festzustellen, ob Oligoharnstoffe reale Peptidstrukturen nachahmen können, stellten die Forscher Hybride aus Peptid und Oligoharnstoff her und und untersuchten deren Bindung an Zielproteine. Eines der Zielproteine, MDM2, ist ein natürlicher Regulator des Tumorsuppressorproteins p53. Das andere, VDR, ist ein Protein, das bei der Regulierung des Zellwachstums, der Immunität und anderer biologischer Funktionen benötigt wird.
Für das Mimetikum des MDM2-bindenden Peptids ersetzten die Forscher drei terminale Aminosäuren des Originalpeptids durch Ureido-Einheiten. Für das VDR-bindende Peptid-Mimetikum ersetzten sie das mittlere Aminosäuresegment durch Ureido-Einheiten. Nach einigen Optimierungsrunden fanden die Autoren Hybridstrukturen mit hohen Bindungsaffinitäten.
Die Hybride besaßen ähnliche Bindungsaffinitäten wie die ursprünglichen Peptide. Eine Röntgenstrukturanalyse ergab eine regelmäßige helikale Strukur für die Hybride. Die Helices waren jedoch etwas breiter als die Alpha-Helix der natürlichen Peptide, und zwischen den Seitenketten am Oligoharnstoff-Rückgrats waren die Abstände größer.
Peptid-Oligoharnstoff-Hybride sollten nicht so leicht proteolytisch abgebaut werden, was für die medizinische Chemie ein entscheidender Faktor ist. Zudem ermöglichen sie mehr Modifikationen. „Alpha-Aminosäuren können an zwei Stellen substituiert werden, aber Ureido-Einheiten haben eine Stelle mehr“, erläutert Guichard. Medikamente aus einem Peptid-Oligoharnstoff-Hybrid sollten somit mehr Möglichkeiten zur Optimierung bieten.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Dr. Léonie Cussol et al.; "Structural Basis for α‐Helix Mimicry and Inhibition of Protein–Protein Interactions with Oligourea Foldamers"; Angewandte Chemie International Edition; 2020
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.

















































