Krebsforscher trainieren weiße Blutkörperchen für Attacken gegen Tumorzellen
Neue Formen der Krebs-Immuntherapie denkbar
Wissenschaftler am Nationalen Centrum für Tumorerkrankungen Dresden (NCT/UCC) und der Hochschulmedizin Dresden konnten gemeinsam mit einem internationalen Forscherteam erstmals zeigen, dass sich bestimmte weiße Blutkörperchen – so genannte Neutrophile Granulozyten – nach Absolvierung eines speziellen Trainingsprogramms möglicherweise zur Behandlung von Tumoren einsetzen lassen.
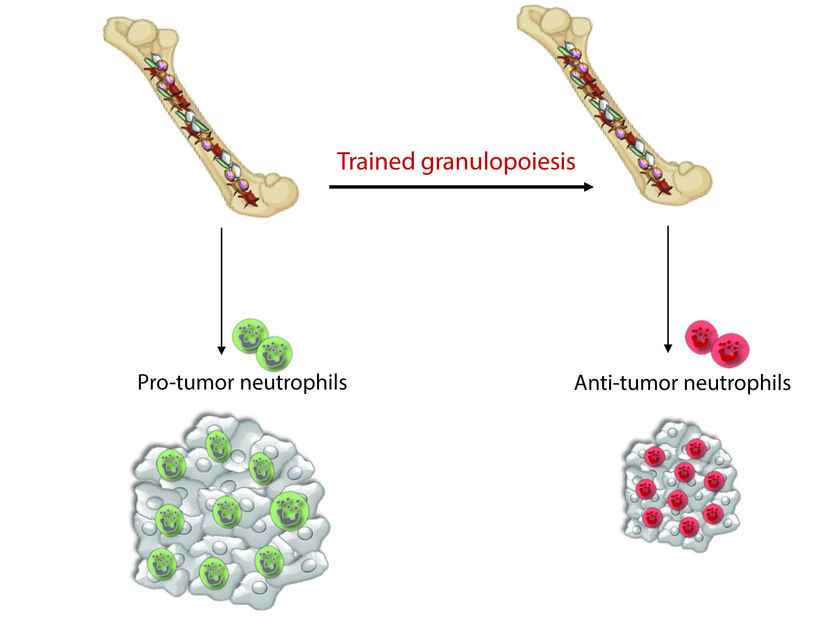
Neutrophile lassen sich durch ein spezielles Training zur Behandlung von Tumoren einsetzen. Die Wirkung des Trainings setzt bereits bei der Blutbildung (Granulopeose) ein.
© Lydia Kalafati
Als Reiz für das Training dieses Teils des angeborenen Immunsystems nutzten sie Beta-Glucan, ein langkettiges Zuckermolekül, das als natürlicher Ballaststoff hauptsächlich in Zellwänden von Pilzen, Hafer oder Gerste vorkommt. Die Wirkung des Immun-Trainings setzte bereits auf der Ebene der Blutbildung im Knochenmark bei den Vorläuferzellen der Neutrophilen Granulozyten ein. Basierend auf dem nun beschriebenen Mechanismus könnten künftig neuartige Krebs-Immuntherapien entwickelt werden, die die Behandlung für Krebspatienten verbessern. Die Wissenschaftler veröffentlichten ihre Ergebnisse im Fachmagazin „Cell“.
Tumorzellen können dem Immunsystem auf verschiedene Weise ausweichen und damit seine schützende Wirkung aushebeln. Immuntherapien zielen darauf ab, diese Ausweichmanöver zu unterbinden und die natürlichen Abwehrmechanismen im Körper der Patienten wieder auf die Krebszellen zu lenken. Moderne Immuntherapien setzen hierbei auf die Spezialisten unseres Abwehrsystems wie T-Zellen, dendritische Zellen oder bestimmte Antikörper. Diese sind als Teil des spezifischen Immunsystems in der Lage, geeignete Strukturen auf Tumor- oder Immunzellen zu erkennen und eine passgenaue Abwehrreaktion einzuleiten oder auszuführen. Wissenschaftler am Nationalen Centrum für Tumorerkrankungen Dresden (NCT/UCC) und der Dresdner Hochschulmedizin konnten nun erstmals zeigen, dass sich auch die unspezifische Immunantwort unseres Körpers durch ein spezielles Training gegen Tumoren in Stellung bringen lässt. „Basierend auf dem beschriebenen Mechanismus sind neue Formen der Krebs-Immuntherapie denkbar, die künftig die Heilungschancen für bestimmte Patienten verbessern könnten“, sagt Prof. Triantafyllos Chavakis, Direktor des Instituts für Klinische Chemie und Laboratoriumsmedizin (IKL) des Universitätsklinikums Carl Gustav Carus Dresden.
Training von Neutrophilen Granulozyten hemmt Tumorwachstum
Im Zentrum des beschriebenen Mechanismus stehen spezielle Immunzellen, so genannte Neutrophile Granulozyten – kurz Neutrophile. Diese bilden die häufigste Untergruppe der weißen Blutkörperchen und sind Teil der angeborenen, unspezifischen Immunabwehr. Anders als der spezifische Anteil unseres Immunsystems, der fremde Strukturen im Körper zunächst genau analysiert, um dann mit zeitlicher Verzögerung maßgeschneiderte Abwehrmechanismen zu aktivieren, fungiert der unspezifische Anteil unserer körpereigenen Abwehr als schnelle Einsatztruppe: Wenn Krankheitserreger in den Körper eindringen oder Zellen entarten, reagiert es sehr rasch und meist stereotyp.
Durch bestimmte Reize lässt sich jedoch auch die unspezifische Immunantwort beeinflussen, gleichsam trainieren. Das Training bewirkt, dass bestimmte Akteure der schnellen Einsatztruppe veränderte Eigenschaften aufweisen und ihre Aufgaben über einen längeren Zeitraum besser erledigen als zuvor – die Truppe gewinnt an Schlagkraft. Die Forscher konnten nun erstmals nachweisen, dass sich dieser Effekt, der bereits bei Infektionen bekannt ist, auch gegen Tumoren nutzen lässt.
Eine wichtige Rolle spielen hierbei die Neutrophilen Granulozyten, die sich bei bestimmten Tumoren verstärkt in der Umgebung des Tumors ansammeln oder in den Tumor einwandern. Diese direkt am Tumor befindlichen, so genannten tumorassoziierten Neutrophile, können das Tumorwachstum hemmen, besitzen zum Teil aber auch tumorfördernde Eigenschaften. Vermutet wird, dass der Tumor selbst Stoffe abgibt, die die Neutrophilen zu Treibern des Tumorwachstums machen. Diesen für den Heilungsprozess negativen Vorgang konnten die Wissenschaftler in experimentellen Modellen durch ein spezielles Training der unspezifischen Immunantwort teilweise umkehren. Als stimulierenden Reiz für das Immunsystem nutzten sie das langkettige Zuckermolekül (Polysaccharid) Beta-Glucan, das als natürlicher Ballaststoff hauptsächlich in Zellwänden von Pilzen, Hafer oder Gerste vorkommt. Die Gabe von Beta-Glucan bewirkte, dass der Anteil der Neutrophilen mit tumorhemmenden Eigenschaften deutlich zunahm und das Tumorwachstum zurückging.
Veränderte Blutbildung sorgt für langfristigen Effekt
Besonders wichtig war hierbei der Nachweis, dass die Umprogrammierung der Neutrophilen Granuloyzenten bereits im Knochenmark einsetzt. Hier entwickeln sich aus Stammzellen verschiedene Vorläuferzellen, aus denen schließlich die unterschiedlichen Blutzellen hervorgehen. Durch die Gabe von Beta-Glucan veränderte sich die Genaktivität der myeloischen Vorläuferzellen, aus denen sich später auch die Neutrophilen entwickeln. „Dies bewirkt, dass sich die Eigenschaften der kurzlebigen Neutrophilen längerfristig hin zu einer gegen den Tumor gerichteten Aktivität verändern. Denn die Vorläuferzellen bilden über einen längeren Zeitraum hinweg Neutrophile mit tumorhemmenden Eigenschaften“, erklärt Co-Erstautorin Lydia Kalafati vom IKL und vom NCT/UCC.
Im nächsten Schritt wäre es denkbar, dass das Prinzip des Neutrophilen-Trainings in Kombination mit bereits zugelassenen Immuntherapien bei Krebspatienten eingesetzt wird. „Dabei wollen wir auch untersuchen, bei welchen Tumorarten die Methode besonders gut wirkt, um sie dann künftig ganz gezielt einsetzen zu können“, sagt Prof. Martin Bornhäuser, Mitglied im geschäftsführenden Direktorium des NCT/UCC und Direktor der Medizinischen Klinik I des Universitätsklinikums Dresden.