Wie tödliche Parasiten in menschliche Zellen „gleiten“
Röntgenanalyse enthüllt Struktur der molekularen Maschinerie von Malaria- und Toxoplasmose-Erregern
Eine Untersuchung an DESYs Röntgenlichtquelle PETRA III gibt Einblick in die molekulare Maschinerie, mit der sich bestimmte Parasiten durch den menschlichen Organismus fortbewegen. Die Studie unter Leitung von Christian Löw von der Hamburger Niederlassung des Europäischen Molekularbiologie-Laboratoriums EMBL hat die sogenannte Gleitbewegung des Malaria- und des Toxoplasmose-Parasiten analysiert. Die Ergebnisse, die das interdisziplinäre Team im Fachblatt „Communications Biology“ vorstellt, können der Suche nach neuen Wirkstoffen gegen die Erreger nutzen.
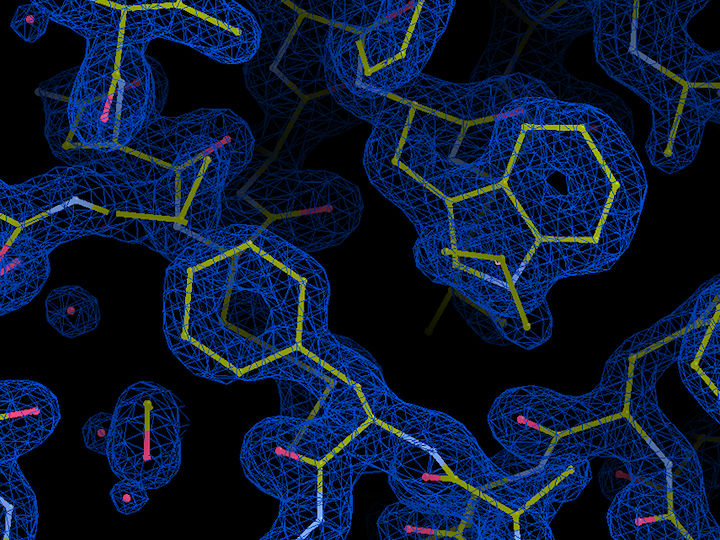
Molekülstruktur in der essenziellen leichten Kette (ELC) im Plasmodium-Glideosom. Blau ist die Elektronendichte im Protein dargestellt, Bindungen zwischen Atomen sind gelb und Wassermoleküle rot. Die Kristallstruktur mit einer räumlichen Auflösung von 1,5 Ångström (0,15 millionstel Millimeter) wurde an den EMBL-Messstationen an DESYs Röntgenlichtquelle PETRA III in Hamburg gewonnen.
EMBL, Samuel Pazicky
Aus biologischer Sicht bezeichnet Gleiten eine Art der Fortbewegung, bei der eine Zelle entlang einer Oberfläche wandert, ohne ihre Form zu verändern. Diese Form der Bewegung kommt nur bei Parasiten aus dem Stamm Apicomplexa vor, wie beispielsweise Plasmodium und Toxoplasma. Beide Parasiten sind von großer globaler Bedeutung für die Gesundheit. Der von Stechmücken übertragene Parasit Plasmodium verursacht 228 Millionen Malariainfektionen und rund 400.000 Todesfälle pro Jahr. Mit dem vor allem von Katzen übertragenen Toxoplasma ist rund ein Drittel der menschlichen Weltbevölkerung infiziert. Er kann bei einigen Menschen schwere Symptome auslösen, ist aber insbesondere während der Schwangerschaft gefährlich.
Das Gleiten ermöglicht es den Apicomplexa-Parasiten, in Wirtszellen einzudringen und sich zwischen ihnen zu bewegen. Wenn beispielsweise ein Plasmodium-Parasit durch einen Mückenstich in den menschlichen Körper gelangt, gleitet er durch die menschliche Haut, bevor er in die Blutgefäße gelangt. Diese Art der Bewegung beruht auf den Proteinen Aktin und Myosin, die auch beim Menschen und anderen Wirbeltieren Muskelbewegungen ermöglichen. Myosin hat dabei die Form einer Art „molekularer Beine“, die entlang der Aktin-Filamente marschieren und dadurch Bewegung erzeugen.
Bei Apicomplexa-Parasiten interagiert das Myosin mit mehreren anderen Proteinen, die zusammen einen Komplex bilden, der als Glideosom bezeichnet wird. Der genaue Mechanismus, mit dem das Glideosom funktioniert, ist nicht gut verstanden, unter anderem weil die molekulare Struktur der meisten Proteine des Glideosoms unbekannt ist. Ein genaueres Verständnis dieses Mechanismus könnte zur Entwicklung von Medikamenten beitragen, die den Zusammenbau des Glideosoms verhindern und dadurch die Krankheitserreger buchstäblich stoppen.
Die EMBL-Forschungsgruppe analysierte die molekulare Struktur sogenannter essenzieller leichter Ketten (ELCs) aus Glideosom-Proteinen, die direkt an Myosin binden. Es war bereits bekannt, dass diese ELC für das Gleiten notwendig sind. Ihre genaue Struktur und Funktion waren bisher jedoch nicht bekannt. Mit Hilfe der Röntgenkristallographie an den EMBL-Messstationen von DESYs Röntgenlichtquelle PETRA III, ergänzt durch Kernspinresonanz-Spektroskopie (NMR), konnten die Forscher nun die molekularen Strukturen von an Myosin A gebundenen ELC für die Parasitenarten Toxoplasma gondii und Plasmodium falciparum bestimmen. Die Ergebnisse zeigen, dass die ELCs wie eine Art molekulare Stelzen funktionieren: Bei der Bindung von Myosin A werden die ELCs starr und beginnen, wie ein Hebelarm zu funktionieren. Diese Versteifung lässt das Myosin längere Schritte machen, was wahrscheinlich die Gleitbewegungen des Parasiten beschleunigt.
Das Team untersuchte auch die Rolle von Kalzium, das bislang als Regulator für das Gleiten galt. Überraschenderweise stellten die Forscher fest, dass Kalzium die Struktur der ELCs jedoch nicht beeinflusst. Es erhöht allerdings die Stabilität des ELC-Myosin-A-Komplexes. Dieses unerwartete Ergebnis illustriert, dass viele Details der Glideosom-Architektur noch unbekannt sind.
Die Arbeiten sind das Ergebnis einer interdisziplinären Zusammenarbeit zwischen Strukturbiologen und Parasitologen des EMBL mit dem Zentrums für Strukturelle Systembiologie (CSSB) auf dem DESY-Campus in Hamburg sowie mit dem Bernhard-Nocht-Institut für Tropenmedizin in Hamburg, der Universität Hamburg und der Martin-Luther-Universität Halle-Wittenberg.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!





















































