Auflösungsweltrekord in der Kryo-Elektronenmikroskopie
Neue Technik macht erstmals einzelne Atome in einem Protein sichtbar
Eine entscheidende Auflösungsgrenze in der Kryo-Elektronenmikroskopie ist geknackt. Holger Stark und sein Team am Max-Planck-Institut (MPI) für biophysikalische Chemie haben zum ersten Mal einzelne Atome in einer Proteinstruktur beobachtet und die bisher schärfsten Bilder mit dieser Methode aufgenommen. Mit solch detaillierten Einblicken lässt sich besser verstehen, wie Proteine in der lebenden Zelle ihre Arbeit verrichten oder Krankheiten hervorrufen. Auch kann die Technik zukünftig eingesetzt werden, um Wirkstoffe für neue Medikamente zu entwickeln.
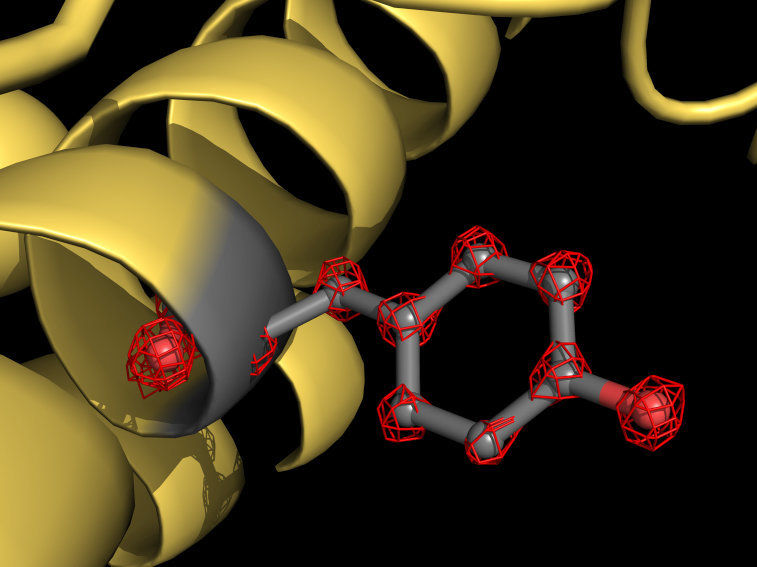
Das Team von Holger Stark hat mit der Kryo-Elektronenmikroskopie erstmals einzelne Atome in einem Protein sichtbar gemacht. Die Cartoon-Darstellung zeigt einen Teils des Apoferritin-Proteins (gelb), bei dem eine Tyrosin-Seitenkette grau herausgehoben ist. Die Aminosäure Tyrosin besteht aus mehreren Atomen, die in der Struktur einzeln erkennbar sind (rote Gitterstrukturen).
© Holger Stark / Max-Planck-Institut für biophysikalische Chemie
Seit Ausbruch der COVID-19-Pandemie ermitteln Wissenschaftler weltweit die Strukturen wichtiger Schlüsselproteine des SARS-CoV-2-Virus in 3D. Ihr gemeinsames Ziel ist es, Andockstellen für einen Wirkstoff zu finden, mit dem der Erreger wirksam bekämpft werden kann.
Möglich macht dies unter anderem die Kryo-Elektronenmikroskopie, mit der sich dreidimensionale Strukturen von Biomolekülen sichtbar machen lassen. Eine große Herausforderung, denn diese sind in ihrer Struktur äußerst flexibel. Um die wuseligen Moleküle einzufangen, ohne sie zu beschädigen, werden diese extrem schnell abgekühlt, sozusagen schockgefroren. Die tiefgefrorenen Proben werden mit Elektronen beschossen und die resultierenden Bilder aufgenommen. Aus den Aufnahmen kann dann die dreidimensionale Struktur der Moleküle berechnet werden. Für die Entwicklung der Kryo-Elektronenmikroskopie erhielten drei Pioniere dieser Technik, Jacques Dubochet, Joachim Frank und Richard Henderson, im Jahr 2017 den Nobelpreis für Chemie.
Auflösungsweltrekord macht einzelne Atome im Protein sichtbar
Starks Gruppe erreichte nun einen entscheidenden Auflösungsrekord mit einem bisher einzigartigen Kryo-Elektronenmikroskop, das das Team neu entwickelt hat. „Unser Mikroskop besitzt zwei zusätzliche optische Elemente, mit denen wir die Bildqualität und Auflösung weiter verbessern konnten. Diese sorgen dafür, dass Abbildungsfehler optischer Linsen, sogenannte Aberrationen, keine Rolle mehr spielen“, erklärt der Max-Planck-Direktor. Seine Doktorandin Ka Man Yip ergänzt: „Elektronenmikroskope sind optische Instrumente und ähneln physikalisch einem Fotoapparat. Die Aberrationen eines Elektronenmikroskops stören in der Kryo-Elektronenmikroskopie ganz ähnlich wie die einer Kamera in der Fotografie. Für eine wesentlich bessere Bildqualität war es daher entscheidend, diese Fehler zu vermeiden.“
Mehr als eine Million Bilder des Proteins Apoferritin hat das Forscherteam mit dem neuen Mikroskop aufgenommen, um die Molekülstruktur mit einer Auflösung von 1,25 Ångström abzubilden. Ein Ångström entspricht dem Zehnmillionstel eines Millimeters. „Damit werden einzelne Atome im Protein sichtbar – ein Meilenstein auf unserem Gebiet“, erklärt Stark. „Für uns war es, als hätte man dem Mikroskop eine Art Super-Brille aufgesetzt.“ Die neue Struktur enthüllt nie zuvor gesehene Details: Selbst an das Apoferritin gebundene Wassermoleküle und Dichten für die Wasserstoff-Atome können wir sehen.“
Das große Potenzial der Kryo-Elektronenmikroskopie, 3D-Strukturen von Proteinen hochaufgelöst abzubilden, belegen auch Kollegen vom Medical Research Council Laboratory of Molecular Biology in Cambridge (Großbritannien), die mit einem anderen Ansatz eine ähnlich hohe Auflösung erzielten. „Es ist nun denkbar, dass sich in Zukunft mit der Kryo-Elektronenmikroskopie selbst Auflösungen im subatomaren Bereich erreichen lassen“, sagt der Max-Planck-Forscher.
Grundlage für maßgeschneiderte Medikamente
Doch welchen Nutzen hat es, eine Proteinstruktur derart hochaufgelöst untersuchen zu können? Will man verstehen, wie eine von Menschenhand gebaute Maschine funktioniert, muss man ihre Bauteile während des Betriebs beobachten. Ähnlich verhält es sich mit Proteinen – den Nanomaschinen lebender Zellen. Will man ihre Funktionsweise entschlüsseln, muss man die exakte Lage aller ihrer Atome kennen.
Solche detaillierten Einsichten sind auch eine wichtige Grundlage für das strukturbasierte Medikamentendesign. Wirkstoffmoleküle für Medikamente werden dafür so maßgeschneidert, dass sie beispielsweise an Virus-Proteine binden und diese in ihrer Funktion blockieren. Doch welcher Mechanismus liegt der Hemmung zugrunde? Dieser lässt sich nur aufklären und verstehen, wenn die Wechselwirkung zwischen Wirkstoff und Virus-Protein auf atomarer Ebene beobachtet werden kann. Die so gewonnenen Erkenntnisse tragen dazu bei, Wirkstoffmoleküle für Medikamente zu verbessern und Nebenwirkungen zu reduzieren. „Mit dem jetzigen Schritt der Auflösungsverbesserung hat die Kryo-Elektronenmikroskopie ein Niveau erreicht, auf dem der Nutzen für pharmazeutische Entwicklungen direkt sichtbar wird“, so Stark.