Die Zacken in der Viruskrone
Forscher wollen Oberflächenprotein des Coronavirus analysieren und so Bindungsstellen für Impfstoffe und Medikamente aufspüren
Das Glykoprotein Spike verleiht dem Coronavirus seinen Namen: Wie Zacken einer Krone stehen die Moleküle von der Virushülle ab. Forscher des Max-Planck-Instituts für Biophysik in Frankfurt analysieren nun die Struktur dieses Proteins. Auf diese Weise wollen sie potenzielle Ziele für Antikörper und Hemmstoffe identifizieren – eine wichtige Voraussetzung für die Entwicklung neuer Impfstoffe und Medikamente gegen das SARS-CoV-2-Virus.
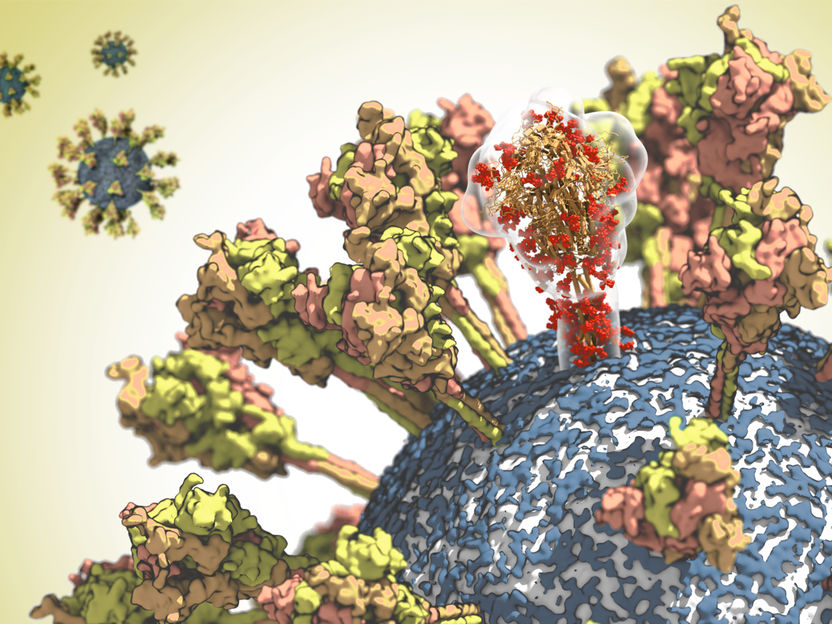
Oberfläche des CoV-2-Virus. Ein Molekül des spike-Proteins ist durchscheinend dargestellt, um seine komplexe räumliche Struktur hervorzuheben.
© MPI f. Biophysik
Das Coronavirus braucht das Spike-Protein, damit es eine Zelle befallen kann. Das Protein bindet vor allem an einen Rezeptor namens ACE2 auf der Oberfläche menschlicher Zellen. Das Virus kann dann mit der Zellmembran verschmelzen und sein Erbgut ins Zellinnere entlassen.
Das Spike-Protein ist aber nicht nur die schärfste Waffe des Virus, es ist auch seine Achillesferse, denn seine exponierte Lage macht es zum bevorzugten Angriffspunkt für das Immunsystem. Antikörper können das Virus anhand des Spike-Proteins erkennen, daran binden und es so als Ziel für Immunzellen markieren. Aber das Virus hat noch einen weiteren Trick auf Lager: Mithilfe von Zuckermolekülen versucht es, seine Spike-Proteine vor den Immunzellen zu verbergen.
Schutzschirm aus Zucker
Die Max-Planck-Forscher analysieren daher nicht nur das Spike-Protein selbst, sondern auch den Zucker-Schutzschirm sowie die Membranhülle des Virus. Sie wollen dabei über die bislang existierenden statischen Strukturen hinaus berechnen, wie sich die Spike-Proteine auf der Virusoberfläche bewegen und wie sie ihre Form verändern – und das mit einer Genauigkeit, die der Größe eines Atoms entspricht.
Diese Berechnungen werden winzigste Details der Proteinstruktur enthüllen. Sie sind aber extrem aufwendig: „Wir brauchen dazu die Supercomputer der Max-Planck-Gesellschaft mit ihrer enormen Rechenleistung“, erklärt Gerhard Hummer, Direktor am Max-Planck-Institut für Biophysik.
Mit ihrem dynamischen Modell des Spike-Proteins wollen die Forscher Bindungsdomänen aufspüren, an die Antikörper verlässlich binden können. Auch Bindungsstellen für Hemmstoffe hoffen Hummer und sein Team so zu entdecken. Diese wollen sie mit den Bindungseigenschaften bereits existierender Medikamente am Computer vergleichen und so Wirkstoffe identifizieren, die das spike-Protein blockieren können. „Medikamente, die bereits auf dem Markt sind, umzuwidmen, geht natürlich viel schneller als neue Wirkstoffe ausfindig zu machen und in langwierigen klinischen Studien zu testen“, sagt Hummer.
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.




















































