Blockierung des Eisentransports könnte Tuberkulose stoppen
Tuberkulose-Bakterien brauchen Eisen zum Überleben. Wird der Eisentransport in den Bakterien gestoppt, so kann sich der Tuberkulose-Erreger nicht weiter vermehren. Nun haben Forscher der Universität Zürich die Struktur des Transportproteins ermittelt, das für die Eisenzufuhr zuständig ist. Dies eröffnet Möglichkeiten zur Entwicklung neuer Medikamente.
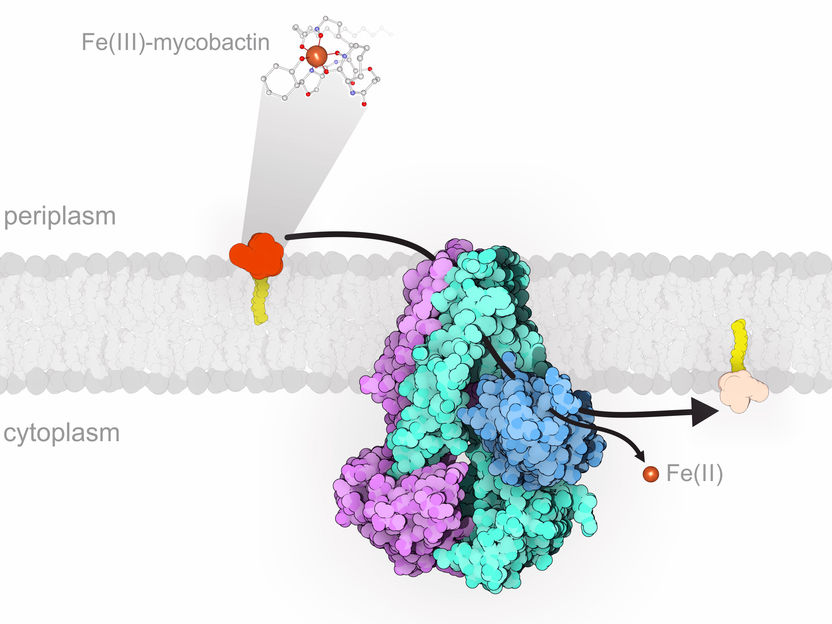
IrtAB (violett/türkis/blau) sitzt in der inneren Membran von M. tuberculosis und importiert eisenbeladenes Mycobactin (gelb/orange) aus der Wirtszelle in die Bakterienzelle, wo das Eisen freigesetzt wird.
Imre Gonda, UZH
Einer der verheerendsten Erreger, der sich im Inneren menschlicher Zellen vermehren kann, ist Mycobacterium tuberculosis – der Bazillus, der Tuberkulose verursacht. Nach Angaben der Weltgesundheitsorganisation WHO starben 2019 rund 1,5 Millionen Menschen an dieser Krankheit, die vorwiegend die Lunge befällt. Besonders besorgniserregend ist die Zunahme multiresistenter M. tuberculosis-Stämme, die gegen viele der wirksamsten Tuberkulose-Antibiotika unempfindlich sind. Neue Medikamente zur Behandlung der Infektionskrankheit werden daher dringend benötigt.
Tuberkulose-Bakterien brauchen Eisen zum Überleben
Alle lebenden Organismen, auch Krankheitserreger, brauchen Eisen, um überleben zu können. Wird eine menschliche Zelle mit Krankheitserregern wie M. tuberculosis infiziert, verringert sie die Eisenkonzentration auf ein Minimum und versucht so, den Eindringling auszuhungern. Die Tuberkulose-Bakterien beginnen darauf, kleine Moleküle – so genannten Mycobactine – freizusetzen. Diese können freies Eisen sehr gut binden und es daher der Wirtszelle entreissen. Das von Mycobactin eingefangene Eisen wird anschliessend von einem Protein namens IrtAB in das Bakterium hinein transportiert.
Ein Forscherteam unter der Leitung von Markus Seeger, Professor am Institut für Medizinische Mikrobiologie der Universität Zürich (UZH), hat nun das Eiweiss, das für den Eisentransport von der Wirtszelle in das Bakterium verantwortlich ist, im Detail analysiert. «Das Transportprotein ist für das Überleben der Erreger unerlässlich. Fehlt IrtAB oder funktioniert es nicht, kann sich M. tuberculosis in der menschlichen Zelle nicht mehr vermehren», sagt Seeger.
Transportprotein funktioniert in umgekehrter Richtung
Mit einer Kombination aus Kryo-Elektronenmikroskopie und Röntgenkristallografie haben die Forschenden erstmals die detaillierte dreidimensionale Struktur des Transportproteins IrtAB bestimmt. Diese Analyse erfolgte in Zusammenarbeit mit Ohad Medalia, Professor am Institut für Biochemie der UZH. Seinem räumlichen Aufbau zufolge gehört IrtAB zu den sogenannten ABC-Exporter. Diese Eiweisse sind typischerweise dafür zuständig, Moleküle aus einer Bakterienzelle hinauszubefördern. «Wir konnten jedoch zeigen, dass IrtAB die Mycobactine in das Bakterium importiert. Anders als erwartet transportiert es also Moleküle in die entgegengesetzte Richtung», erklärt Seeger.
Gemeinsam mit Wissenschaftlern der Universität von Texas, USA, entdeckte das Forscherteam eine weitere Besonderheit des Transportproteins: IrtAB kann das an Mycobactin gebundene Eisen chemisch verändern, nachdem es in das Bakterium importiert wurde. Dadurch wird das Eisen im Zellinnern freigesetzt und das leere Mycobactin kann wiederverwendet werden.
Neuer Angriffspunkt für eine Tuberkulose-Therapie
«IrtAB ist ein potenzieller Angriffspunkt gegen den Erreger. Wird das Eiweiss ausgeschaltet, wird M. tuberculosis inaktiv und unfähig, weitere Zellen zu infizieren. Dank der nun aufgeklärten Struktur und Funktion des Transportproteins eröffnen sich neue Wege, die Eisenzufuhr in die Bakterien mit einem Wirkstoff gezielt zu unterbinden», sagt Markus Seger. «Angesichts der Krankheit Covid-19, die ebenfalls primär die Lunge angreift, wird die Tuberkulose in Zukunft vermutlich wieder eine wichtigere Rolle spielen. Es ist durchaus denkbar, dass durch Covid-19 geschwächte Patienten häufiger von Tuberkulose befallen werden.»