Klinische Studie des NIH zu Remedesivir zur Behandlung von COVID-19 beginnt
An der University of Nebraska Medical Center (UNMC) in Omaha hat eine randomisierte, kontrollierte klinische Studie zur Bewertung der Sicherheit und Wirksamkeit des antiviralen Remdesivirs bei hospitalisierten Erwachsenen mit der Diagnose Coronavirus-Krankheit 2019 (COVID-19) begonnen. Der Sponsor der Studie ist das National Institute of Allergy and Infectious Diseases (NIAID), das zu den National Institutes of Health (NIH) gehört. Dies ist die erste klinische Studie in den Vereinigten Staaten, die eine experimentelle Behandlung für Covid-19 evaluiert, der Atemwegserkrankung, die erstmals im Dezember 2019 in Wuhan, Provinz Hubei, China, festgestellt wurde.
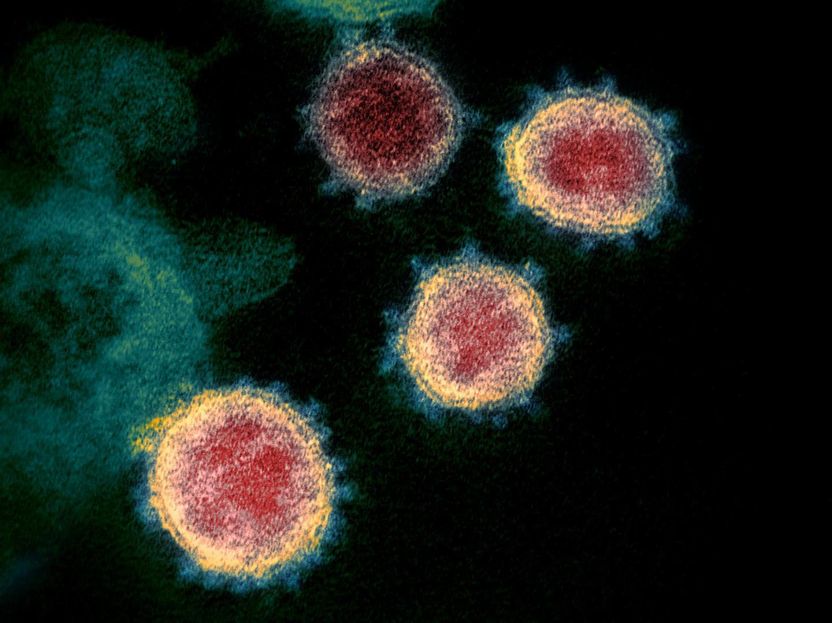
Dieses Transmissionselektronenmikroskop-Bild zeigt SARS-CoV-2--auch bekannt als 2019-nCoV, das Virus, das COVID-19 verursacht--isoliert von einem Patienten in den USA. Es werden Viruspartikel gezeigt, die aus der Oberfläche von im Labor kultivierten Zellen austreten. Die Stacheln am äußeren Rand der Viruspartikel geben den Coronaviren ihren Namen, kronenartig.
NIAID RML
Der erste Studienteilnehmer ist ein Amerikaner, der nach der Quarantäne auf dem Kreuzfahrtschiff Diamond Princess, das in Yokohama, Japan, angedockt hatte, in seine Heimat zurückgeführt wurde und sich freiwillig an der Studie beteiligte. Die Studie kann so angepasst werden, dass zusätzliche investigative Behandlungen evaluiert und Teilnehmer an anderen Standorten in den USA und weltweit aufgenommen werden können.
Es gibt keine spezifischen Therapeutika, die von der Food and Drug Administration (FDA) zur Behandlung von Menschen mit COVID-19, der durch das neu aufkommende SARS-CoV-2-Virus (früher bekannt als 2019-nCoV) verursachten Krankheit, zugelassen sind. Eine Infektion kann leichte bis schwere Atemwegserkrankungen verursachen, und die Symptome können Fieber, Husten und Kurzatmigkeit sein. Bis zum 24. Februar meldete die Weltgesundheitsorganisation (WHO) 77.262 bestätigte Fälle von COVID-19 und 2.595 Todesfälle in China und 2.069 Fälle von COVID-19 und 23 Todesfälle in 29 anderen Ländern. Nach Angaben der Centers for Disease Control and Prevention (CDC) wurden in den Vereinigten Staaten 14 bestätigte COVID-19-Fälle gemeldet und weitere 39 Fälle bei Personen, die in die Vereinigten Staaten zurückgeführt wurden.
Das von Gilead Sciences Inc. entwickelte Remdesivir ist eine antivirale Breitbandbehandlung. Es wurde zuvor an Menschen mit Ebola-Virus-Krankheit getestet und hat sich in Tiermodellen zur Behandlung des Atemwegssyndroms im Nahen Osten (MERS) und des schweren akuten Atemwegssyndroms (SARS), die durch andere Coronaviren verursacht werden, als vielversprechend erwiesen.
"Wir brauchen dringend eine sichere und wirksame Behandlung für COVID-19. Obwohl Remedesivir einigen Patienten mit COVID-19 verabreicht wurde, haben wir keine soliden Daten, die darauf hinweisen, dass es die klinischen Ergebnisse verbessern kann", sagte der Direktor des NIAID und Mitglied der US-Coronavirus-Task-Force, Anthony S. Fauci, M.D. "Eine randomisierte, plazebokontrollierte Studie ist der Goldstandard, um festzustellen, ob eine experimentelle Behandlung den Patienten zugute kommen kann.
Auch in China laufen klinische Studien mit Remdesivir. NIAID entwickelte die aktuelle Studie unter Berücksichtigung dieser Designs und in Übereinstimmung mit den von der WHO einberufenen Konsultationen zur Entwicklung einer therapeutischen Studie für Patienten mit COVID-19.
Teilnehmer an der von den NIH gesponserten Studie müssen eine im Labor bestätigte SARS-CoV-2-Infektion und Beweise für eine Beteiligung der Lunge haben, einschließlich Rasselgeräusche beim Atmen (Rasseln) mit der Notwendigkeit von zusätzlichem Sauerstoff oder abnormalen Röntgenaufnahmen des Brustkorbs oder einer Krankheit, die eine mechanische Beatmung erfordert. Personen mit bestätigter Infektion, die leichte, kälteähnliche Symptome oder keine offensichtlichen Symptome haben, werden nicht in die Studie aufgenommen. In Übereinstimmung mit den Standardprotokollen der klinischen Forschung werden die berechtigten Patienten ihre informierte Zustimmung zur Teilnahme an der Studie geben.
Alle potenziellen Teilnehmer werden vor der Behandlung einer grundlegenden körperlichen Untersuchung unterzogen. Die berechtigten Studienteilnehmer werden dann nach dem Zufallsprinzip entweder der Untersuchungsgruppe oder der Placebogruppe zugeordnet. Die Studie ist doppelblind, was bedeutet, dass die Prüfer und Teilnehmer der Studie nicht wissen, wer Remedesivir oder Placebo erhält. Die Teilnehmer der Studiengruppe erhalten am ersten Tag der Einschreibung in die Studie 200 Milligramm (mg) Remdesivir intravenös. Sie erhalten weitere 100 mg pro Tag für die Dauer des Krankenhausaufenthaltes, insgesamt bis zu 10 Tagen. Die Placebogruppe erhält in gleicher Menge eine Lösung, die Remidesivir ähnelt, aber nur inaktive Bestandteile enthält.
Die Ärzte werden die Teilnehmer regelmässig überwachen und ihnen tägliche Punktzahlen auf der Grundlage einer vordefinierten Skala klinischer Ergebnisse zuweisen, die unter anderem Faktoren wie Temperatur, Blutdruck und die Verwendung von zusätzlichem Sauerstoff berücksichtigt. Die Teilnehmer werden auch gebeten, etwa alle zwei Tage Blutproben sowie Nasen- und Rachenabstriche zu entnehmen. Die Forscher werden diese Proben auf SARS-CoV-2 testen.
Zunächst werden die Prüfärzte die Ergebnisse der Teilnehmer am 15. Tag sowohl in der Remidesivir- als auch in der Placebogruppe vergleichen, um festzustellen, ob das Prüfpräparat den klinischen Nutzen im Vergleich zu Placebo erhöht. Die Ergebnisse werden auf einer Sieben-Punkte-Skala bewertet, die von der vollständigen Genesung bis zum Tod reicht. Die Ermittler werden diese Skala nach Prüfung der Daten der ersten 100 Teilnehmer neu bewerten.
Ein unabhängiges Daten- und Sicherheitsüberwachungsgremium (DSMB) wird die laufenden Ergebnisse überwachen, um das Wohlbefinden und die Sicherheit der Patienten sowie die Integrität der Studie zu gewährleisten. Das DSMB wird die Einstellung der Studie empfehlen, wenn es klare und substanzielle Beweise für einen Behandlungsunterschied zwischen Medikament und Placebo gibt.
Dr. med. Andre Kalil, Professor für Innere Medizin an der UNMC und Arzt für Infektionskrankheiten an der Nebraska Medicine, leitet die Studie an der UNMC. Dreizehn Personen, die vom US-Außenministerium vom Kreuzfahrtschiff Diamond Princess zurückgeführt wurden, wurden am 17. Februar 2020 in die Nationale Quarantäneeinheit transportiert, die sich im Trainings-, Simulations- und Quarantänezentrum auf dem UNMC/Nebraska-Medizincampus in Omaha befindet. Die Passagiere befanden sich in einer Umgebung, in der eine erhebliche Verbreitung von COVID-19 stattgefunden hatte, und wurden zur weiteren Isolierung und möglicherweise zur weiteren Betreuung in die Einheit geschickt. Die CDC hat inzwischen berichtet, dass 11 Personen in der UNMC-Einheit eine SARS-CoV-2-Infektion bestätigt haben.
Die nationale Quarantäneeinheit der UNMC wird durch das Büro des Assistant Secretary for Preparedness and Response (ASPR) im Ministerium für Gesundheit und menschliche Dienste unterstützt. Sie verfügt über eine Kapazität von 20 Betten und befindet sich in unmittelbarer Nähe der Nebraska Biocontainment Unit, falls ein höheres Maß an Betreuung erforderlich sein sollte. Die Teilnehmer an klinischen Studien werden in der Bioabdichtungseinheit betreut.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.






















































