Molekulare Maschine entwirrt verklumpte Proteine
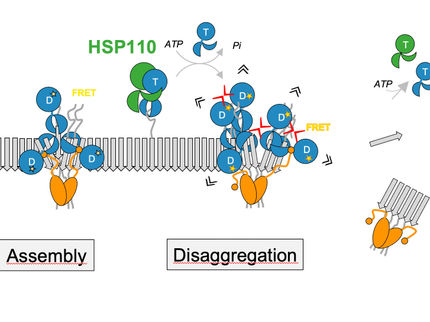
Wie entwirren Zellen Proteine, die verklumpt und damit funktionsunfähig sind? Forscher vom AMOLF-Institut in Amsterdam sowie vom Deutschen Krebsforschungszentrum und der Universität Heidelberg haben die Funktionsweise einer molekularen Maschine charakterisiert, die an freiliegenden Schleifen der Proteinketten zieht und sie so aus dem Proteinknäuel herauslöst.
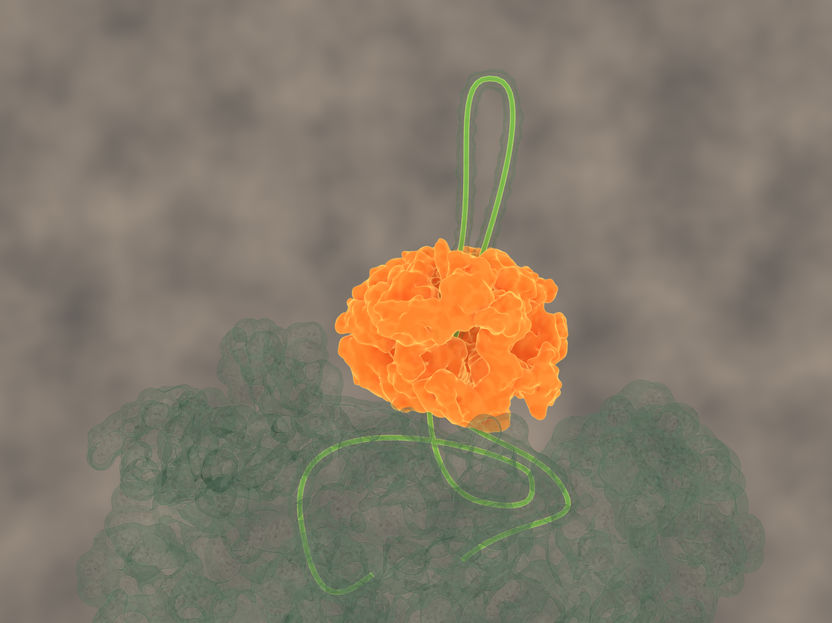
Das Chaperon ClpB zieht eine freie Proteinkette durch seine zentrale Pore
Avellaneda & Tans, AMOLF Amsterdam
Verklumpte, aggregierte und damit funktionsunfähige Proteinketten gelten als mitverantwortlich für zelluläre Alterungsprozesse und zahlreiche Krankheiten einschließlich neurodegenerativer Leiden wie zum Beispiel der Alzheimer-Demenz. Alle Organismen haben daher als „Chaperone" bezeichnete Moleküle entwickelt, um solche schädlichen Aggregate wieder aufzulösen. Wie die Chaperone diese Aufgabe meistern, war allerdings weitgehend unbekannt.
Auf diese Frage haben Mario Avellaneda und Sander Tans am AMOLF-Institut in Amsterdam zusammen mit Bernd Bukau und Axel Mogk, Deutsches Krebsforschungszentrum und Universität Heidelberg, nun wichtige Antworten gefunden.
„Das ringförmige bakterielle Chaperon ClpB greift sich eine freie Schleife der Proteinkette, die aus dem Proteinaggregat herausragt, und zieht sie unter Aufwendung von Kraft durch seine zentrale Pore. Der gesamte Proteinklumpen ist zu groß, um durch die Pore zu passen. Durch die Zugkraft kann ClpB jedoch einzelne Proteinketten aus dem größeren Aggregat herausziehen. Das Chaperon funktioniert dabei wie eine Art Motor", erläutert Bernd Bukau, dessen Arbeitsgruppe sowohl im Deutschen Krebsforschungszentrum als auch im Zentrum für Molekulare Biologie der Universität Heidelberg (ZMBH) angesiedelt ist.
Nach dem Herauslösen aus dem Aggregat kann sich die Proteinkette wieder zusammenfalten und normal funktionieren. Indem alle Proteine einzeln extrahiert werden, kann das Chaperon das gesamte Aggregat vollständig entwirren.
Die Forscher vermaßen die winzigen Bewegungen, die während der Proteinextraktion erfolgen, mit einer „optischen Pinzette". Deren Funktion beruht darauf, dass Licht auf mikroskopische Objekte (z.B. Kügelchen) eine Kraft ausübt und diese dadurch bewegt werden können. Durch das Verankern einer Proteinkette zwischen zwei Kügelchen lassen sich so Strukturänderungen der Proteinkette messen. Dies ermöglichte den Forschern genau zu bestimmen, wie der ClpB-Motor Proteinketten transportiert. Wurden die mechanischen Hebel (aromatische Aminosäuren), die im Inneren der Pore von ClpB sitzen, durch Mutationen verändert, so verlor das Chaperon seine Zugkraft.
Die Wissenschaftler wollen als nächstes untersuchen, ob auch Chaperone aus menschlichen Zellen als Zugmaschinen für aggregierte Proteinketten wirken.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.