Erste dynamische Bilder zeigen Funktion von Rhomboid-Proteasen
Rhomboid-Proteasen sind klinisch relevante Zellmembran-Proteine, die bei verschiedenen Krankheiten eine Rolle spielen. Mittels Festkörper-NMR-Spektroskopie haben Forscher vom Berliner Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) nun erstmals Rhomboid-Proteasen in einer natürlichen Lipidumgebung bei der Arbeit zuschauen können. Die erlangten dynamischen Bilder legen die Grundlagen, um neue Medikamente zu entwickeln, beispielsweise gegen Parkinson oder Malaria.
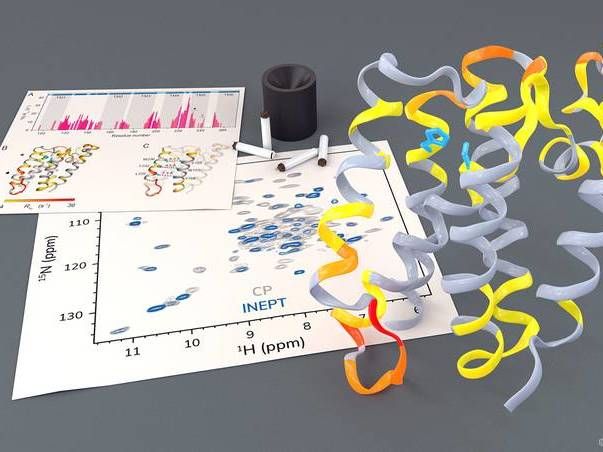
Untersuchung der Rhomboidprotease GlpG mit Hilfe von Festkörper-NMR.
Barth van Rossum, FMP
In unseren Zellen arbeiten rund um die Uhr Zehntausende Proteine. Ein Teil dieser fleißigen Arbeiter sitzt in der Zellmembran; so auch die Familie der sogenannten Rhomboid-Proteasen. Da diese Intramembran-Proteasen an vielen biologischen Prozessen beteiligt sind und auch bei Krankheiten wie Parkinson, Diabetes, Krebs und Malaria eine Rolle spielen, sind sie klinisch höchst relevant.
Bislang konnten Rhomboid-Proteasen mit der Röntgenkristallografie sichtbar gemacht werden. Diese Untersuchungen liefern allerdings nur statische Bilder aus einer künstlichen Umgebung, weshalb offen blieb, was in der Zellmembran passiert, wenn die Proteine ihre Hauptaufgabe verrichten, nämlich andere Membranproteine zu schneiden und damit eine Signalkaskade auszulösen.
Das vermutete Tor, das sich öffnet, gibt es tatsächlich
Diesen äußerst komplexen Prozess hat die Arbeitsgruppe von Prof. Adam Lange vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) nun zum ersten Mal mit der Festkörper-NMR-Spektroskopie sichtbar machen können, und zwar in einer weitgehend natürlichen Umgebung. Die Forscher konnten beobachten, wie sich welche Teile der Rhomboid-Protease bewegen und dass sich zum Schneiden anderer Proteine kurzzeitig ein Gate öffnet, damit das zu schneidende Protein zum aktiven Zentrum der Protease gelangen kann.
Arbeit legt Grundlagen für neue Medikamente
Das Projekt wurde im Rahmen des Exzellenz Clusters UniSysCat durchgeführt und legt die Grundlagen, um Rhomboid-Proteasen noch besser zu charakterisieren. Mehr noch: Das gewonnene Wissen ist hilfreich für Untersuchungen, wie man die klinisch relevanten Membranproteine pharmakologisch beeinflussen kann. Auch Lange und seine Mitarbeiter wollen jetzt nach Substanzen suchen, um fehlgeleitete Rhomboid-Proteasen zu hemmen.
Originalveröffentlichung
Chaowei Shi*, Carl Öster*, Claudia Bohg, Longmei Li, Sascha Lange, Veniamin Chevelkov, Adam Lange; "Structure and Dynamics of the Rhomboid Protease GlpG in Liposomes Studied by Solid-State NMR"; Journal of the American Chemical Society; October 2019; *equally contributing first authors.
Meistgelesene News
Originalveröffentlichung
Chaowei Shi*, Carl Öster*, Claudia Bohg, Longmei Li, Sascha Lange, Veniamin Chevelkov, Adam Lange; "Structure and Dynamics of the Rhomboid Protease GlpG in Liposomes Studied by Solid-State NMR"; Journal of the American Chemical Society; October 2019; *equally contributing first authors.
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.