Gleichgewicht finden: Mechanismus zur Kontrolle von Autoimmunität entdeckt
Anzeigen
B-Zellen sind weiße Blutkörperchen, die Antikörper gegen eine fast unbegrenzte Anzahl von Krankheitserregern bilden, eine Fähigkeit, die für jeden höheren Organismus lebenswichtig ist. Der Aufbau eines vielfältigen Repertoires der Pathogenerkennung hat jedoch seinen Preis, da immer einige B-Zellen rabiat werden und sich gegen das eigene, gesunde Gewebe des Organismus richten.
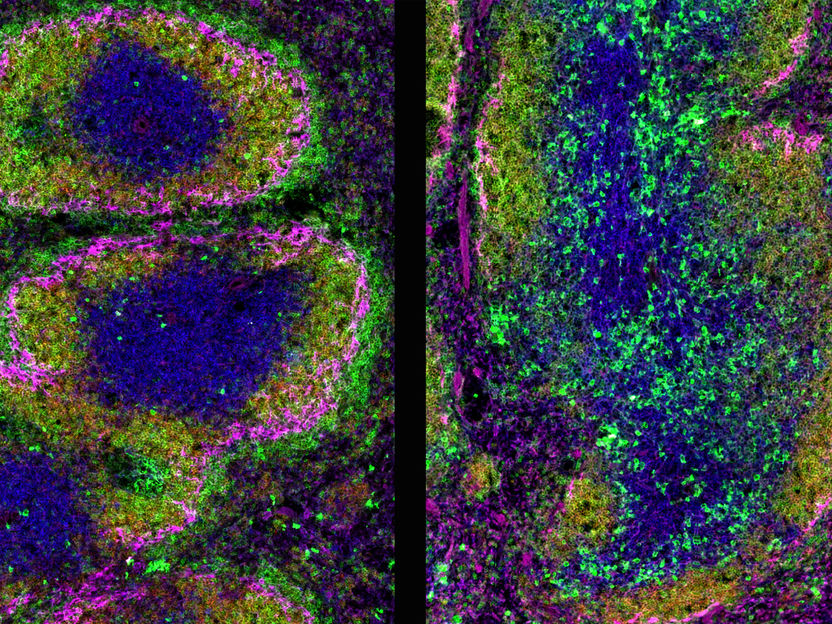
Querschnitt durch die Milz einer 10 Wochen alten Maus. Immunfluoreszenzfärbung.
IMP / W. Masselink
Solche autoreaktiven B-Zellen müssen ruhiggestellt werden und für Notfälle bereit stehen, wie etwa schwere Infektionen mit Krankheitserregern, für die keine spezifische B-Zelle im aktiven B-Zellpool enthalten ist. Wissenschaftler aus dem Labor von Meinrad Busslinger am Forschungsinstitut für Molekulare Pathologie (IMP) haben die beiden antagonistischen Mechanismen untersucht, die autoreaktive B-Zellen stilllegen oder erwecken. Beide Mechanismen werden durch das Protein Ikaros gesteuert und kontrollieren damit die Autoimmunität - wie die Forscher nun in der Zeitschrift Nature Immunology berichten.
Bemerkenswert ist, dass der Ausgangspunkt des Projekts gar nicht das Thema Autoimmunität war, sondern die Frage, wie der Transkriptionsfaktor Ikaros die Differenzierung von B-Zellen beeinflussen kann.
Transkriptionsfaktoren sind Proteine, die an bestimmte Teile der DNA binden, um Gene spezifisch zu aktivieren oder zu unterdrücken. "Wenn einen interessiert, wie ein Transkriptionsfaktor funktioniert, sieht man sich in der Regel erst an, was er in der frühen oder späten B-Zell-Entwicklung tut. Das geht, indem man den Faktor selektiv deaktiviert", erläutert Meinrad Busslinger den gewählten Ansatz.
In reifen B-Zellen von Mäusen beobachteten die Wissenschaftler in Abwesenheit von Ikaros ein hohes Maß an Autoimmunität. Deshalb wandten sie sich den beiden Mechanismen zu, welche die B-Zellen ein- und ausschalten: "Anergy" des B-Zell-Antigen-Rezeptors (BCR) ist ein Toleranzmechanismus, der autoreaktive B-Zellen unempfindlich gegenüber Selbstantigenen macht, und die Signalwirkung des "Toll-ähnlichen Rezeptors (TLR)" aktiviert B-Zellen.
"Wir konnten zeigen, dass in Abwesenheit von Ikaros BCR-Anergy abnimmt, die TLR-Signalisierung zunimmt und B-Zellen hyperaktiv werden. Das führte in den betroffenen Mäusen zu einer systemischen Autoimmunität", sagt Tanja Schwickert, Erstautorin der Studie, die weiter untersuchte, wie Ikaros die beiden Mechanismen, die diese Signalstörungen verursachen, gezielt steuert. Die Resultate unterstützten das Hauptergebnis der Studie: "Ikaros fungiert als zentraler Schalter, der Autoimmunität verhindert."
Das Forschungsprojekt begann mit der Entwicklung eines Mausmodells zur Untersuchung der Funktion von Ikaros in reifen B-Zellen im Jahr 2012. "An dieser Stelle konnte noch niemand ahnen, dass wir Ikaros als einen grundlegenden Regulator der Autoimmunität identifizieren werden", sagt Meinrad Busslinger. Er betrachtet die Entdeckung dieser Verbindung nun als Glücksfall: "So funktioniert die Grundlagenforschung -wir stellen eine grundlegende Frage und erarbeiten Mechanismen mit unerwarteten, aber sehr weitreichenden Auswirkungen auf alle Arten von Phänomenen". In diesem Fall wurden zwei Mechanismen entdeckt, durch die ein einziges Protein ausreicht, um die Autoimmunität zu kontrollieren.
Beim Menschen wurden Ikaros-Mutationen als Risikofaktor für den systemischen Lupus erythematodes (SLE) identifiziert, eine Autoimmunerkrankung, die nicht heilbar ist und die Lebenserwartung der betroffenen Patienten drastisch verkürzt. Die vorliegende Studie wird dazu beitragen, diese Erkrankung in den Kontext eines grundlegenden Mechanismus zu stellen, der an der Entstehung von Autoimmunerkrankungen beteiligt sein könnte.