Krebs in seinen Wachstumsstrategien (aus)bremsen
Neue Studie identifiziert Angriffsziel für Krebstherapien im Chromatin-Baumeister BAF
Jede fünfte menschliche Krebserkrankung weist Mutationen in einem Mitglied des BAF-Komplexes (BAF Chromatin remodeling complex) auf. Die umfassende biochemische und epigenetische Charakterisierung der BAF-Mutationen liefert neue Ansätze für die Bekämpfung von durch diese verursachten Krebserkrankungen. Die Studie, die am CeMM Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften durchgeführt wurde, wurde vom Wissenschaftsmagazin Nature Genetics veröffentlicht.
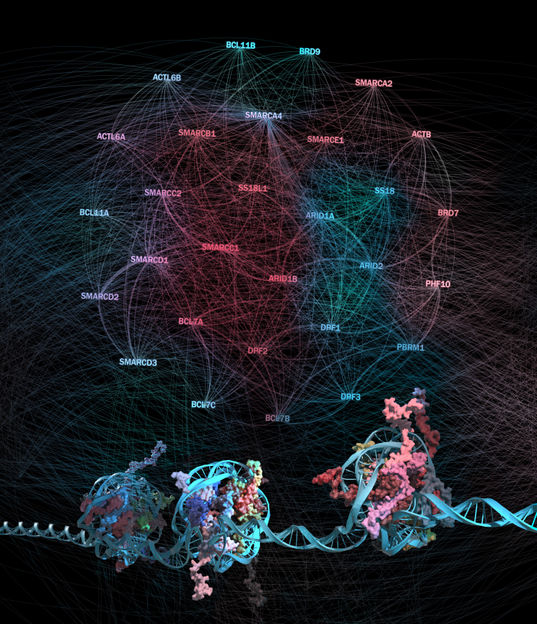
Protein-protein interaction network between subunits of the BAF chromatin remodeling complexes and their connection to chromatin regions they regulate
© CeMM/Bobby Rajesh Malhotra
Chromatin organisiert die etwa zwei Meter DNA, die sich im Zellkern jeder menschlichen Zelle befinden so, dass - abhängig vom Zelltyp und -zustand - bestimmte Gene aktiviert und andere abgeschaltet werden können. Die grundlegende Organisationseinheit des Chromatins ist das Nukleosom, das aus 146 DNA-Basenpaaren besteht, die um ein Histon-Oktamer gewickelt sind. Wann immer eine Zelle sich anpassen muss - zum Beispiel an Entwicklungs- oder Umweltsignale, oder um DNA-Schäden zu reparieren – muss sie die Zugänglichkeit ihrer DNA verändern. Dafür verantwortlich sind Chromatin-Remodellierungs-Komplexe, welche die Energie von ATP nutzen, um Nukleosomen zu bewegen oder zu entfernen. Chromatin-Remodellierungs-Komplexe kommen in menschlichen Zellen in vielfältigen Ausprägungen vor. Besondere Bedeutung hat dabei der BAF-Komplex, wobei es sich hier nicht nur um einen einzigen Komplex handelt, sondern tatsächlich um viele verschiedene: Bis zu fünfzehn Positionen des Komplexes können von Proteinen besetzt werden, welche wiederum von 29 verschiedenen Genen kodiert werden. In Summe ergeben sich dadurch mehr als 10.000 theoretisch mögliche Komplexe.
Bei etwa zwanzig Prozent aller menschlichen Krebserkrankungen wird eine Mutation in einem der BAF-Komplex Gene gefunden. Wie diese Mutationen zur Krebsentstehung beitragen, ist derzeit weitgehend unbekannt. Noch problematischer ist, dass bis dato keine Therapien für die gezielte Behandlung von durch BAF-Mutationen verursachten Krebs verfügbar sind. Die Entwicklung solcher Therapien gestaltet sich schwierig, da die genetischen Veränderungen in der Regel zu einem Funktionsverlust führen: In den Krebszellen fehlen spezifischen Proteine aus einem der zahlreichen BAF-(Sub)-Komplexe, und es schwierig ist, ein Medikament gegen etwas zu entwickeln, das nicht vorhanden ist.
Sandra Schick, Postdoktorandin im Labor von Stefan Kubicek im CeMM, stellte sich der Herausforderung: Um dennoch mögliche Angriffspunkte in BAF-mutierten Zellen zu finden, generierte sie im ersten Schritt ein relevantes Zellmodell mit 22 genetisch identen Zelllinien, die sich nur durch das Fehlen jeweils einer BAF-Untereinheit unterschieden. In all diesen Zelllinien charakterisierte sie zunächst die Folgen des Verlusts einzelner Untereinheiten für die Zusammensetzung der Komplexe, die Zugänglichkeit von Chromatin sowie die Transkription. „Wir konnten bestimmte Ausprägungen der BAF-Komplexe identifizieren, die sich ändern, wenn einzelne Untereinheiten verloren gehen“, so Schick, "darüber hinaus konnten wir intensive Wechselwirkungen zwischen diesen Untereinheiten beobachten, die dazu führen, dass - abhängig vom verlorenen Gen - andere BAF-Untereinheiten mit größerer oder geringerer Häufigkeit eingebaut werden." Die Daten weisen darauf hin, dass, obwohl die ursprüngliche Mutation zum Verlust einer BAF-Untereinheit führt, die krebsfördernden Eigenschaften möglicherweise durch eine fehlerhafte Funktion der verbleibenden BAF-Komplexe verursacht werden. Und genau diese könnten Ansatzpunkte für zielgerichtete Therapien sein.
Um zu testen, ob das ungehemmte Zellwachstum tatsächlich von den verbleibenden BAF-Komplexen abhängig ist, eliminierte das Team systematisch ein zweites Mitglied der BAF-Komplexe in den Zellen, die bereits eine Untereinheit verloren hatten. In diesem riesigen Datensatz fanden sich vor allem drei Kombinationen von ausgeschalteten BAF-Untereinheiten, welche die Fitness der Zellen reduzierten (SMARCA4-ARID2, SMARCA4-ACTB und SMARCC1-SMARCC2). Die umfangreichen systematischen Daten zur Interaktions-Proteomik, zur Zugänglichkeit von Chromatin und zu Veränderungen der Transkription halfen dabei, den molekularen Mechanismus für diese synthetischen Wechselwirkungen zu erklären. „Noch wichtiger war für uns jedoch der Nachweis, dass diese neuartigen Kombinationen auch über unser zellulares Modellsystem hinaus in weiteren relevanten Krebszelllinien Bestand haben“, erklärt Stefan Kubicek. Und genau das konnten die Forscher in einem Panel von 22 verschiedenen Krebszelllinien nachweisen. "Die SMARCC1-SMARCC2-Kombination führte zu einem besonders starken Wachstumsnachteil, der stark konserviert war. Wir konnten zeigen, dass Zelllinien mit niedrigen SMARCC1-Proteinmengen äußerst empfindlich auf den Verlust von SMARCC2 reagieren."
Das Projekt, das im Rahmen des Christian Doppler Laboratory für Chemische Epigenetik in Zusammenarbeit mit Boehringer Ingelheim durchgeführt wurde, bot nicht nur einen tiefen molekularen Einblick in die biochemischen und epigenetischen Veränderungen nach dem Verlust einer BAF-Untereinheit. Es ist auch ein weiterer Schritt zum Ziel, neue Angriffspunkte für die gezielte Behandlung für BAF-mutierte Krebsarten zu entwickeln.






















































