Wie synthetische Zellen schädliche Bakterien bekämpfen
Wissenschaftler des DWI – Leibniz-Institut für Interaktive Materialen in Aachen entwickelten gemeinsam mit Kollegen an der University of Pennsylvania, der Temple University, der RWTH Aachen und vom Max-Planck-Institut für medizinische Forschung ein außergewöhnliches Konzept für die Bekämpfung schädlicher Bakterien. Resultat ihrer jüngsten Arbeit, deren Ergebnisse in der Fachzeitschrift Nano Letters (1) veröffentlicht wurden, sind künstliche Zellen, die Bakterien aufspüren und verschlingen können. Mit diesen künstlichen phagozytischen Zellen verfolgt das Team einen neuen Ansatz zur Behandlung bakterieller Infektionen als Alternative zur Therapie mit Antibiotika. Teilweise haben Bakterien jedoch bereits Resistenzen gegen Antibiotika entwickelt und gedeihen in deren Gegenwart sogar besonders gut. Bereits jetzt sterben weltweit jährlich 700.000 Menschen aufgrund antibiotikaresistenter Keime und Schätzungen zufolge könnte diese Zahl in den kommenden Jahren dramatisch ansteigen; die Rede ist sogar von 10 Millionen Fällen im Jahr 2050 (2).
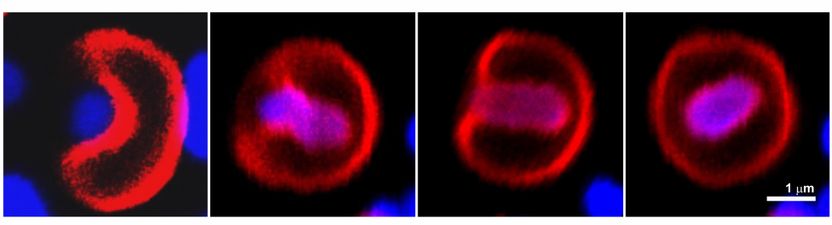
Mikroskopbilder zeigen, wie synthetische Zellen (rot) ein lebendes Bakterium auffressen (blau).
Copyright: ACS Nano Letters
"Antibiotika und andere antimikrobielle Wirkstoffe sind so konzipiert, dass sie bestimmte Strukturen in Bakterien angreifen. Doch die Bakterien entwickeln sich weiter und können dagegen immun werden. Unser Ansatz unterscheidet sich radikal von der Behandlung mit Antibiotika. Unsere künstliche Zelle frisst das gesamte Bakterium in einem einzigen Bissen auf und gibt ihm nicht die Möglichkeit, Resistenzen zu entwickeln", sagt Dr. Cesar Rodriguez-Emmenegger, Leiter dieser Forschungsarbeit.
Im ersten Schritt bindet das Bakterium an die Membran der synthetischen Zelle, woraufhin sich die Membran einstülpt und das Bakterium schließlich komplett umgibt. Es entsteht eine Struktur, die dem Verdauungssack von Makrophagen ähnelt. Sobald das Bakterium von der Membran der synthetischen Zelle umschlossen ist, kann es sich nicht mehr vermehren oder Biofilme bilden. Nun kann das Bakterium innerhalb der synthetischen Zelle abgetötet werden. Giftige Abbaustoffe werden auf diese Weise vom umliegenden Gewebe ferngehalten.
„Als wir diesen Vorgang zum ersten Mal unter dem Mikroskop beobachten konnten und gesehen haben, dass unser Ansatz funktioniert, waren wir extrem begeistert“, sagt Wissenschaftlerin Dr. Nina Kostina. "Die ganz besonderen Eigenschaften der Membran der synthetischen Zellen schaffen die Voraussetzungen für den Prozess“, erklärt Dr. Khosrow Rahimi, der ebenfalls am Forschungsprojekt mitwirkt. „Die Membran muss einerseits die Bakterien binden können und muss andererseits sehr elastisch sein, damit sie sich einstülpen und das Bakterium umschließen kann. Darüber hinaus muss die Membran im biologischen Milieu stabil bleiben.“
Die Kombination dieser Eigenschaften in einer einzigen Membran war die größte Herausforderung bei der Entwicklung der synthetischen Zellen auf Polymer- oder Lipidbasis. Um diese Herausforderung zu bewältigen, nutzte das Team eine neue Klasse von künstlichen Zellmembranen, bei denen Lipide oder Polymere durch sogenannte Janus-Dendrimere ersetzt wurden. Wie Janus, der römische Gott mit zwei Gesichtern, haben diese Moleküle wasserliebende und wasserabweisende Komponenten. Das führt zur spontanen Bildung künstlicher Zellen, deren Membran wichtige Eigenschaften einer natürlichen Zellmembran aufweist. "Besonders faszinierend an diesen künstlichen Zellen finden wir die Tatsache, dass wir in der Molekularstruktur der Janus-Dendrimere die Flexibilität und Stabilität der Membran sowie ihre Fähigkeit, Bakterien aufzuspüren und selektiv zu binden, programmieren können", erklärt Kostina. "Jetzt haben wir ein sehr leistungsfähiges Werkzeug, mit dessen Hilfe wir die Wechselwirkungen der Membran mit Bakterien ganz präzise definieren können."
Derzeit arbeitet das Team daran, natürliche Rezeptoren in die synthetische Zelle zu integrieren, um ihnen die Möglichkeit zu geben, zwischen verschiedenen Bakterienstämmen zu unterscheiden (3). Die Wissenschaftler denken, dass ihre synthetischen Zellen durch die Einführung bestimmter Glykosphingolipide oder Proteine, die in natürlichen Zellen vorkommen, in der Lage sein werden, Krankheitserreger selektiv einzufangen und dabei andere Bakterien zu ignorieren.
Rodriguez-Emmenegger arbeitet derzeit zusammen mit Prof. Dr. Martin Möller und Prof. Dr. Joachim Spatz – sie sind ebenfalls Koautoren dieser Veröffentlichung – an der Umsetzung dieser Forschung in die medizinische Anwendung. Die künstlichen Zellen sollen zukünftig helfen, den Bakterienbefall auf orthopädischen Implantaten zu reduzieren und so deren chirurgischen Ersatz zu minimieren. Wenn es gelänge, die künstlichen Zellen auf der Oberfläche von Implantaten zu platzieren, könnten sie bestimmte Bakterien ‚einfangen‘ und in ihrem Inneren unschädlich machen, ohne toxische Moleküle freizusetzen. Dies würde letztendlich die Lebensdauer der Implantate verlängern und dem Patienten viel Leid und Kosten ersparen.
Cesar Rodriguez-Emmenegger ist überzeugt, dass dieses Konzept die Entwicklung völlig neuer, intelligenter antimikrobieller Mittel ermöglichen wird. Der biomimetische Mechanismus erzeugt im Gegensatz zu Antibiotika keinen selektiven Druck, der zur Entstehung resistenter Bakterienstämme führen könnte.
Originalveröffentlichung
(1) N. Kostina, K. Rahimi, Q. Xiao, T. Haraszti, S. Dedisch, J. P. Spatz, U. Schwaneberg, M. L. Klein, V. Percec, M. Moeller, C. Rodriguez-Emmenegger; Nano Lett; 2019.
(2) Tackling drug-resistant infections globaly: final report and recommendations, The review on antimicrobial resistance chaired by Jim O’Neill, 2016.
(3) C. Rodriguez-Emmenegger, et al.; Proc Natl Acad Sci U S A 2019, 116, 5376-5382.