Körpereigenes Protein löst Entzündungsreaktion aus
FHR1 verschlechtert Gesundheitszustand von Patienten mit chronischen Zellschädigungen
Wissenschaftler aus Jena haben ein menschliches Eiweiß identifiziert, das autoinflammatorische Reaktionen auslöst. Das ist vor allem bei chronischen Erkrankungen problematisch: Ist die Entzündung sonst ein Teil des Heilungsprozesses, verschlimmert sie die Lage bei Patienten mit etwa chronischen GefäßEntzündungen genannt Vaskulitiden.
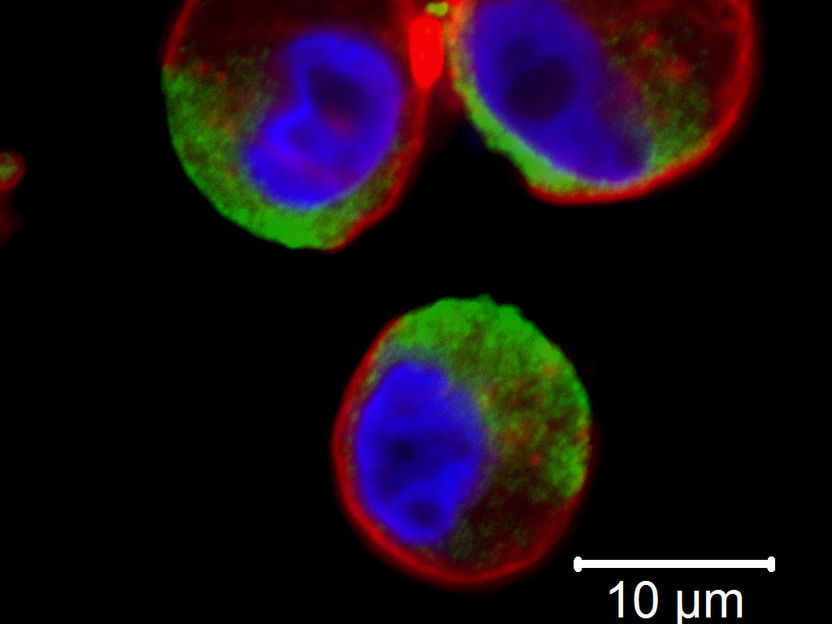
Absterbende Zellen (rot): Die grüne Farbe zeigt die Stellen, an denen das Molekül FHR1 bereits andocken konnte.
Christine Skerka, Leibniz-HKI
Langanhaltende Entzündungen sind Begleiterscheinungen vieler Krankheiten. Besonders bei Infektionen mit Bakterien, Pilzen oder Viren dienen sie dazu, die Vermehrung der Erreger durch eine Temperaturerhöhung zu bremsen und Bestandteile des Immunsystems zu aktivieren, die den Heilungsprozess unterstützen. Bei chronischen autoinflammatorischen Erkrankungen tritt die Entzündungsreaktion allerdings nicht in den Heilungsprozess über. Körpereigene Zellen geraten aus ihrem Gleichgewicht und der Krankheitsprozess wird so verstärkt. Der Verlauf ist oft chronisch oder tritt schubweise auf und verursacht typische Beschwerden wie Fieber, Schmerzen und Müdigkeit.
Ein von Jenaer Wissenschaftlern geleitetes Forscherteam hat jetzt ein Eiweiß identifiziert, das für sogenannte autoinflammatorische Reaktionen beim Menschen verantwortlich ist. Das körpereigene Faktor H-verwandte Protein FHR1 bindet an absterbende Zellen, die bei verschiedenen Krankheiten im Menschen entstehen. Damit setzt es eine Entzündungsreaktion in Gang, welche die Krankheit verstärkt und das Befinden der Patienten stark beeinträchtigen kann. Betroffen sind verbreitete Krankheiten aber auch seltene Erkrankungen wie die ANCA-assoziierten Vaskulitiden (AAV). Bei dieser langanhaltenden Erkrankung handelt es sich um eine seltene, potenziell lebensbedrohliche systemische Schädigung der kleinen und mittleren Gefäße. Diese und weitere chronische Erkrankungen sind dadurch gekennzeichnet, dass körpereigene Zellen absterben und – häufig durch Einlagerung weiterer Substanzen – Beläge in den Blutgefäßen verursachen, welche so die Blutzirkulation behindern. Hiervon können besonders die Nieren betroffen sein, deren Filtrationsleistung dadurch sinkt.
„Wir konnten in unserer Studie nachweisen, dass FHR1-Moleküle spezifisch an absterbende Zellen in den Blutgefäßen binden, während nah verwandte Proteine wie Faktor H oder FHR2 und FHR3 dies nicht tun“, sagt die Leiterin der Studie, Christine Skerka. Die Professorin für Immunregulation leitet am Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie – Hans-Knöll-Institut – eine Arbeitsgruppe, die sich mit dem komplexen Zusammenspiel von Molekülen des Immunsystems bei infektiösen und nichtinfektiösen Krankheiten befasst. „Die Bindung von FHR1 an die Zelloberfläche löst die Aktivierung des Immunproteins NLRP 3 (das Inflammasom) im Körper aus, wodurch schließlich eine ganze Entzündungskette in Gang gesetzt wird, die in einer Autoinflammation mündet“, so Skerka weiter. Die Ergebnisse der Studie decken sich mit der Beobachtung, dass ein Mangel an FHR1 vor bestimmten Krankheiten schützt. Das Protein FHR1 könnte damit ein erfolgversprechendes Ziel für Medikamente sein, um Entzündungsreaktionen im Körper zurückzufahren. Antikörper, die FHR1 inhibieren, wurden bereits erfolgreich in vitro getestet.