Erste Studie mit hochauflösender Kryomikroskopie in Spanien entdeckt neue Funktionen von Chaperonen
Molekulare Chaperone sind der Schlüssel zum Gleichgewicht zwischen Synthese und Abbau von zellulären Proteinen
Eine Arbeit, die von Forschern des Nationalen Biotechnologiezentrums des Spanischen Nationalen Forschungsrates (CSIC) gemeinsam geleitet wurde, hat den Wirkmechanismus des CCT-Komplexes bestimmt, einem der wichtigsten molekularen Chaperone in eukaryontischen Organismen. Die Wissenschaftler, die ihre Ergebnisse in Nature Communications veröffentlichen, haben ein modernes elektronisches Kryomikroskop verwendet.
CNB-CSIC
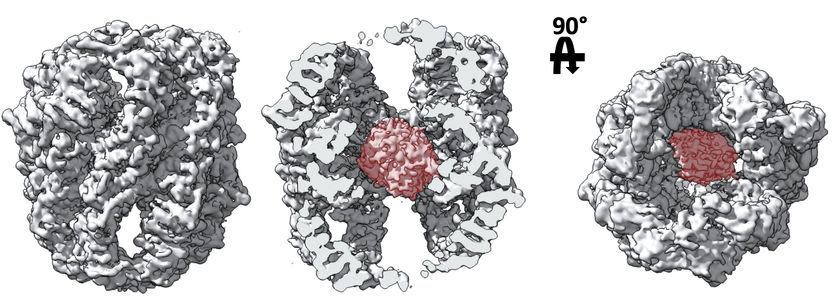
Das untersuchte molekulare Chaperon, das aus zwei Ringen besteht, die aus acht verschiedenen Proteinen bestehen, ist an der Faltung essentieller Proteine beteiligt, wie zum Beispiel derjenigen, die das Zellgerüst bilden oder Komplexe, die für verschiedene zelluläre Signalprozesse verantwortlich sind.
"Bis vor kurzem wurde angenommen, dass die Interaktion zwischen diesem Chaperon und ihren Zielproteinen, wie bei anderen Chaperonen in ihrer Familie, am Eingang zum Hohlraum jedes der beiden Ringe stattfand und dass sie auch unabhängig voneinander agierten. Unsere Arbeit beschreibt jedoch, wie sich CCT auf mindestens einem seiner Substrate (mLST8) unterschiedlich verhält, was für die Zellsignalisierung von grundlegender Bedeutung ist", sagt José María Valpuesta vom National Biotechnology Center, der die Arbeit gemeinsam geleitet hat.
Visualisierung komplexer Prozesse
Die elektronische Kryomikroskopie ist eine Technik, die es ermöglicht, die dazugehörigen Zellen und Proteinkomplexe mit großem Detailreichtum zu beobachten. Dank des elektronischen Kryomikroskops der neuesten Generation, das kürzlich im National Biotechnology Centre, dem einzigen seiner Art in Spanien, installiert wurde, hat die Auflösung 4 Angström erreicht (ein Zentimeter entspricht 10 Millionen Angström).
"Das interessanteste Ergebnis hat mit der strukturellen Bestimmung des zwischen CCT und mLST8 gebildeten Komplexes zu tun", erklärt Jorge Cuellar, Forscher im gleichen Zentrum.
Den Forschern ist es gelungen, die Peptidketten der 16 Untereinheiten zu verfolgen und zwei sehr neue Details zu zeigen: dass das mLST8-Substrat innerhalb der Struktur verbunden ist und dass es keine Trennung zwischen den beiden Ringen des Chaperons zu geben scheint, da mLST8 zwischen den beiden platziert ist. Der Befund verändert das Arbeitsmodell dieses Chaperons völlig und weist darauf hin, dass diese Regionen eine bisher unbekannte Funktion haben.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Spanisch finden Sie hier.
Originalveröffentlichung
Jorge Cuéllar, W. Grant Ludlam, Nicole C. Tensmeyer, Takuma Aoba, Madhura Dhavale, César Santiago, M. Teresa Bueno-Carrasco, Michael J. Mann, Rebecca L. Plimpton, Aman Makaju, Sarah Franklin, Barry M. Willardson & José M. Valpuesta; "Structural and functional analysis of the role of the chaperonin CCT in mTOR complex assembly."; Nature Communications.