Weitere Optimierung einer enzymatischen Synthesestrategie für ein pharmazeutisches Schlüsselintermediat
Eine ökonomisch signifikante Prozessintensivierung zur effizienten enzymatischen Synthese von (1S,2R)-1-(Methoxycarbonyl) cyclohex-4-ene-2-carbonsäure wurde durch eine Optimierung des Reaktionsmodus erreicht, welche Massentransferlimitierungen minimiert.

Enzymicals AG

Abbildung 1 (1S,2R)-Monoester, Schlüsselintermediat für verschiedene biologisch aktive Moleküle.
Enzymicals AG
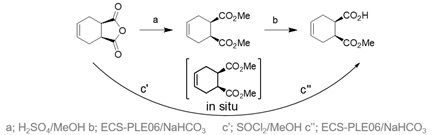
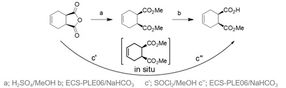
Abbildung 2 Konventionelle(a,b) und Mehrschritt Eintopf (c’, c’’) Syntheseweg zum (1S,2R)-Monoester.
Enzymicals AG

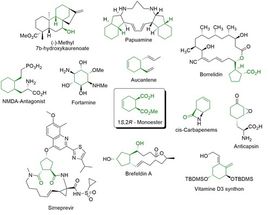
(1S,2R)-1-(Methoxycarbonyl) cyclohex-4-ene-2-carbonsäure (1S,2R-Monoester) ist ein Schlüsselintermediat für verschiedene biologisch aktive Moleküle (Abbildung 1) welches von der Enzymicals AG als Katalogprodukt etabliert wurde.
Eine erste Syntheseroute wurde mit der Entwicklung einer neuen biokatalytischen Mehrstufen-Eintopfreaktion etabliert.[1] Indem der Reaktionsmodus auf ein chemo-enzymatisches Reaktionskonzept umgestellt wurde, welches die Produktaufarbeitung vereinfachte und die isolierte Ausbeute verbesserte, wurden die Produktionskosten 2015 wettbewerbsfähig (Abbildung 2). Das Verfahren war hinsichtlich pH-Wert und Temperaturoptimum detailliert charakterisiert, und mit der rekombinanten Schweineleberesterase ECS-PLE06, die ebenfalls bei Enzymicals erhältlich ist, wurden Vollumsätze mit einem ausgezeichneten Enantiomerenüberschuss (> 99,5%) erzielt.
Weitere Entwicklungen in Zusammenarbeit mit zwei akademischen Partnern konzentrierten sich auf den Einfluss von Massentransferlimitierung durch das schwer wasserlösliche Substrat, was in vorangegangenen Studien nicht im Detail betrachtet wurde. Das Hauptziel bestand dabei darin, die Gesamtproduktivität des Prozesses zu steigern und die industriellen Anforderungen für einen Batchprozess zu erfüllen. Zu diesem Zweck wurde eine neu entwickelte Reaktionskurvenanalyse-Methodik angewendet, die eine weitere Optimierung des Herstellungsprozesses ermöglichte. Als Ergebnis wurde die biokatalytische Synthese des Zielproduktes in Konzentrationen von 75 g·L-1 erreicht und die Produktivität des Biokatalysators auf 4,36 gProdukt·gbiocat-1 bei einer Raum-Zeitausbeute von 20,2 g·L-1·h-1 erhöht.[2]
Diese erfolgreiche Prozessoptimierung ist das Ergebnis einer Zusammenarbeit der Enzymicals AG, Dr. Jan von Langermann, Gruppe Biokatalytische Synthese an der Universität Rostock und Prof. John M. Woodley, Abteilung für chemische und biochemische Verfahrenstechnik an der Technischen Universität Dänemark.
Originalveröffentlichung
[1] Süss P., Borchert S., Hinze J., Illner S., v. Langermann J., Kragl U., Bornscheuer U.T., Wardenga R.; "Chemoenzymatic Sequential Multistep One-Pot Reaction for the Synthesis of (1S,2R)-1-(Methoxycarbonyl)cyclohex-4-ene-2-carboxylic Acid with Recombinant Pig Liver Esterase"; Org. Process Res. Dev.; 2015, 19 (12), pp 2034–2038.
[2] Meissner M.P., Süss P., Brundiek H., Woodley J.M., v. Langermann J.; "Scoping the Enantioselective Desymmetrization of a Poorly Water-Soluble Diester by Recombinant Pig Liver Esterase"; Org. Process Res. Dev.; 2018, 22, 1518−1523.