Informationen in die Zelle bringen
Forscher des Paul Scherrer Instituts PSI haben einen wichtigen Teil eines Signalweges aufgeklärt, der Informationen durch die Zellmembran in das Innere einer Zelle überträgt. Dieser Signalweg ist für alle Säugetiere von großer Bedeutung, da er an verschiedenen wichtigen Lebensprozessen wie der Regulation des Herzschlags beteiligt ist. Drei Proteine übermitteln dabei die Informationen in das Zellinnere. Volodymyr Korkhov, Biochemiker am PSI, und seinem Team gelang es, eine Momentaufnahme des dritten Proteins, der sogenannten Adenylylzyklase, zu machen und ihre Struktur mit nahezu atomarer Auflösung zu bestimmen. Durch die Bestimmung der Struktur dieser Komponente entdeckten die Forscher, wie sie sich selbst regulieren kann.
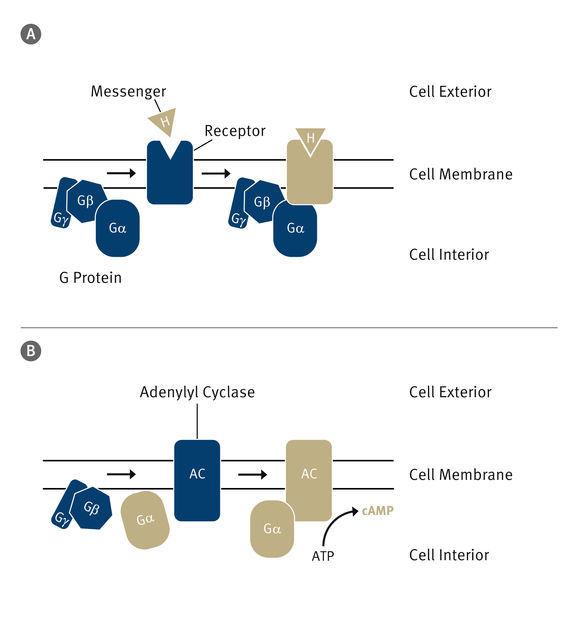
Das Zellinnere ist durch die Zellmembran gegen Einflüsse von aussen geschützt. Um Informationen in die Zelle zu schleusen, die ein Botenstoff (H) übermittelt, existieren spezielle Signalwege. A: Der Botenstoff dockt an einen Rezeptor in der Membran an und aktiviert diesen (hier verdeutlicht durch den Farbwechsel). Der Rezeptor aktiviert wiederum ein G-Protein. B: Von diesem spaltet sich die α-Untereinheit ab und bindet an den letzten Teil des Signalwegs, ein Protein mit dem Namen Adenylylzyklase. Dieses stellt aus ATP – einem Energiespeicher der Zelle – sogenanntes zyklisches AMP her (cAMP), einen wichtigen sekundären Botenstoff in der Zelle.
Paul Scherrer Institute/Markus Fischer
Das Zellinnere aller lebenden Zellen wird durch Membranen von der Außenwelt getrennt. Diese Membranen halten die Zellen insgesamt intakt und schützen sie vor negativen Einflüssen. Sie wirken aber auch als Barriere für Vitalstoffe und Informationen. Aus diesem Grund enthalten Zellmembranen Mechanismen, die einen gezielten Zugang gewünschter Substanzen ermöglichen oder Informationen externer Signale in die Zelle übertragen.
Ein wichtiger Signalweg bei Säugetieren besteht aus drei Komponenten: Erstens einem Rezeptor, der das Signal erkennt und dadurch aktiviert wird. Zweitens einem sogenannten G-Protein, das an den aktivierten Rezeptor bindet und das Signal an ein oder mehrere Effektorproteine weiterleitet. In diesem Fall ist der Effektor die Adenylylzyklase, die dritte Komponente der Signalkette. Dieses Protein wird durch eine Untereinheit des G-Proteins aktiviert und produziert in einer biochemischen Reaktion einen sekundären Botenstoff, das sogenannte zyklische AMP (cAMP).
cAMP löst verschiedene Reaktionen in der Zelle aus, zum Beispiel erhöht es die Durchlässigkeit der Membran für Kalzium in Herzzellen, was zu einer Steigerung der Herzschlagfrequenz führt.
Forscher des Paul Scherrer Instituts PSI in Villigen haben nun mithilfe der Elektronenmikroskopie eine spezielle Art dieser Adenylylzyklasen abgebildet und das bislang detailreichste Bild von dieser Art Membranprotein erhalten.
Hilfreiche Selbsthemmung
«Um zu verstehen, wie Signalwege in der Zelle funktionieren, ist es zunächst notwendig zu wissen, wie die beteiligten Komponenten im Detail aussehen», sagt Volodymyr Korkhov, Leiter der Forschungsgruppe Mechanismen der Signaltransduktion im Bereich Biologie und Chemie am PSI und Assistenzprofessor am Institut für Biochemie der ETH Zürich. «Unsere Arbeit ist ein wichtiger Beitrag zur Aufklärung der genauen Funktion der Adenylylzyklase in der cAMP-Signalkette.»
«Überraschenderweise haben wir durch die Bestimmung der Struktur der Adenylylzyklase, die an die Alpha-Untereinheit des G-Proteins gebunden ist, entdeckt, dass das Protein in der Lage zu sein scheint, sich selbst zu hemmen», sagt Biochemiker Korkhov. Ein Teil des Proteins ist für diese Selbsthemmung verantwortlich. Dieser Teil blockiert das aktive Zentrum des Enzyms und verhindert die Überproduktion von cAMP.
Die neue Erkenntnis zur Molekularstruktur der Adenylylzyklase liefert ein viel besseres Verständnis davon, wie externe Signale zur kontrollierten Produktion des wichtigen sekundären Botenstoffs cAMP führen. Die Konzentration von cAMP in Zellen spielt eine wichtige Rolle bei der Entstehung von Herz-Kreislauf-Erkrankungen, bestimmten Tumoren oder Typ-2-Diabetes. «In Zukunft könnten es unsere neuen Erkenntnisse ermöglichen, Medikamente zu identifizieren, die die Adenylylzyklase hemmen oder aktivieren – je nachdem, ob Überproduktion oder ein Mangel an cAMP für eine Krankheit verantwortlich ist», erklärt Korkhov.
Mikroskopie bei tiefen Temperaturen
Ihre Ergebnisse erzielten die Forscher mithilfe der Kryoelektronenmikroskopie (Kryo-EM). Diese Form der Transmissionselektronenmikroskopie verwendet Temperaturen unter -150 Grad Celsius. Die zu untersuchende Probe wird in flüssigem Ethan schockgefroren, wodurch die natürliche Struktur der Probe erhalten bleibt. Diese Methode wird zunehmend für die Untersuchung biologischer Strukturen eingesetzt und wurde 2017 mit dem Nobelpreis ausgezeichnet. «Es ist spannend, einen tiefen Einblick in die Struktur der Adenylylzyklase zu bekommen», sagt Chao Qi, Doktorand im Labor von Korkhov und Erstautor der Studie. «Die Struktur dieses Proteins war seit seiner Entdeckung jahrzehntelang schwer fassbar, und ich bin froh, dass ich diese Struktur mit Kryo-EM während meiner Doktorarbeit aufklären konnte.»
Die von den PSI-Forschern in ihren Untersuchungen erzielte Auflösung betrug 3,4 Ångström. Ein Ångström entspricht einem Zehnmillionstel eines Millimeters. Isolierte Atome haben einen Radius von 0,3 bis 3 Ångström.