Ein molekularer Schalter für das X-Chromosom
Grundlegender Mechanismus zur Einleitung der Inaktivierung von X-Chromosomen im weiblichen Organismus aufgeklärt
Im Verlauf der Entwicklung müssen eine Vielzahl an Genen zu unterschiedlichen Zeitpunkten an- oder abgeschaltet werden. Eine besondere Herausforderung besteht, wenn in einer Zelle zwei Kopien des gleichen Gens unterschiedliche Aktivierungszustände einnehmen sollen, wie es zum Beispiel bei den X-Chromosomen im weiblichen Organismus der Fall ist. Wissenschaftler am Berliner Max-Planck-Institut für molekulare Genetik haben diesen Vorgang untersucht und ein grundsätzliches Modell für die Einleitung der X-Inaktivierung durch das RNA-Molekül Xist entwickelt. Danach wird die Wirkung von Xist durch einen Repressor unterdrückt, der sich jeweils auf demselben Chromosom befindet und auch nur auf diesem wirksam wird. Sein Gegenspieler, der für die Aktivierung von Xist erforderlich ist, wirkt auf alle Xist-Gene, unabhängig davon, auf welchem X-Chromosom sie liegen. Das Modell stellt einen allgemeingültigen Mechanismus zur Einleitung der Inaktivierung von X-Chromosomen bei verschiedenen Säugetierspezies vor und schafft die Voraussetzungen für die Identifizierung der molekularen Mechanismen, die für diesen Vorgang erforderlich sind.
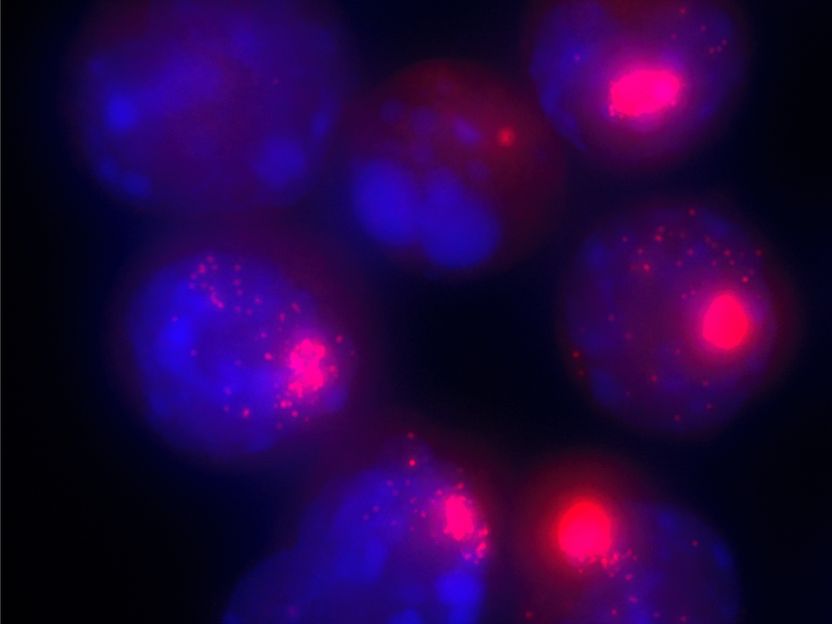
Zellkerne von weiblichen Zellen. Die Xist-Moleküle, die für die Inaktivierung des zweiten X-Chromosoms verantwortlich sind, sind mit einem roten Farbstoff markiert.
Verena Mutzel / Max-Planck-Institut für molekulare Genetik
Bei Säugern einschließlich des Menschen wird das genetische Geschlecht durch die Geschlechtschromosomen X und Y bestimmt. Anders als die übrigen Chromosomen bilden diese kein homologes Paar, sondern enthalten unterschiedliche Gene und unterscheiden sich häufig auch schon in ihrer äußeren Form voneinander. Weibliche Zellen enthalten in der Regel zweimal das gleiche Geschlechtschromosom (XX), männliche Individuen haben ein Y-Chromosom, das das männliche Geschlecht bestimmt und ein X-Chromosom. Auch alle anderen Chromosomen kommen in doppelter Anzahl vor. Diese Autosomen tragen aber im Regelfall jeweils die gleichen Gene, die sich lediglich in der jeweiligen Ausprägung voneinander unterscheiden.
Die Anzahl der in aktiver Form im Organismus vorhandenen gleichen Gene wird als Gendosis bezeichnet. Bei Säugern ist die Gendosis streng festgelegt. Wenn zum Beispiel durch angeborene Erkrankungen einzelne Gene fehlen oder zusätzlich vorhanden sind, kann dies zu unterschiedlich stark ausgeprägten Störungen führen. Eines der bekanntesten Beispiele dafür ist das Down-Syndrom (Trisomie 21), bei dem das Chromosom 21 und damit auch jedes der auf dem Chromosom vorhandenen Gene in jeder Körperzelle nicht zweimal, sondern dreimal vorkommt.
Weibliche und männliche Organismen benötigen gleiche Dosis an X-kodierten Genen
Die richtige Gendosis ist auch für die Gene auf dem X-Chromosom von Bedeutung. „Für die normale Funktion benötigt jeder Organismus, egal ob männlich oder weiblich, nur die Gendosis, die von einem X-Chromosom bereitgestellt wird“, erklärt Edda Schulz, Leiterin der Max-Planck-Forschungsgruppe „Regulatorische Netzwerke in Stammzellen“ am Berliner Max-Planck-Institut für molekulare Genetik. „Der weibliche Organismus hat jedoch im Regelfall zwei X-Chromosomen. Er muss daher sicherstellen, dass die Gene eines X-Chromosoms ausgeschaltet bzw. inaktiviert werden.“
Genau diese Inaktivierung interessiert Schulz. Gemeinsam mit ihrem Team untersucht sie, wie weibliche Säugetiere in jeder ihrer Zellen eines der beiden X-Chromosomen ausschalten, während das eine X-Chromosom in männlichen Zellen aktiv bleibt. Bereits seit einiger Zeit ist bekannt, dass die Gene eines X-Chromosoms mithilfe einer langen nicht-kodierenden RNA namens Xist stillgelegt werden. Aber Xist wird von beiden X-Chromosomen kodiert. Warum entfaltet es nur bei einem davon seine Wirkung? Warum wirkt Xist nicht auch auf das zweite X-Chromosom und warum entsteht an den X-Chromosomen von männlichen Zellen kein Xist?
Repressoren und Aktivatoren in cis und trans
In zahlreichen Untersuchungen wurde festgestellt, dass bei unterschiedlichen Spezies unterschiedliche Faktoren an der Regulation von Xist beteiligt sind. Einige davon unterdrücken seine Wirkung (Repressoren), während andere diese erst ermöglichen bzw. verstärken (Aktivatoren). Weiterhin wirken einige Faktoren nur auf die Gene, die mit ihnen auf demselben Chromosom liegen – die Forscherinnen und Forscher sprechen in diesem Fall von einer cis-Regulation. Andere Faktoren wirken auf alle Kopien ihres Zielgens, egal, ob sich diese auf demselben oder einem anderen Chromosom befinden. Dieser Fall wird als trans-Regulation bezeichnet. Bislang existierte aber noch kein allgemeingültiges Modell, mit dem das grundsätzliche Zusammenspiel der regulatorischen Faktoren bei der X-Inaktivierung erklärt werden konnte.
Mathematische Modelle zur Simulation der X-Inaktivierung
Schulz und ihr Team entwickelten daher eine Reihe von mathematischen Modellen, um die verschiedenen Möglichkeiten des Zusammenspiels von Aktivatoren und Repressoren untersuchen zu können. Sie unterteilten die beteiligten Faktoren danach, ob sie Xist aktivieren oder unterdrücken, ob sie ihre Wirkung nur auf dem Chromosom entfalten, auf dem sie liegen, oder auch auf weitere X-Chromosomen in der Zelle wirken und ob sie während der X-Inaktivierung abgeschaltet werden oder ihre Funktion erhalten bleibt. „Nur mit einem der von uns entwickelten Modelle konnte sichergestellt werden, dass Xist nur bei einem von zwei X-Chromosomen aktiviert wird“, erklärt Verena Mutzel, die die Berechnungen durchgeführt hat. „Damit in allen Zellen, männlich wie weiblich, ein X-Chromosom aktiv bleiben kann, muss sich der Repressor für Xist auf demselben Chromosom befinden und darf auch nur auf diesem wirksam sein (cis). Damit in Zellen mit mehr als einem X-Chromosom aber nur ein X-Chromosom aktiv bleibt, muss sich auf den X Chromosomen zusätzlich ein Aktivator für Xist befinden, der auch in trans-Position wirksam ist.“
Doppelte Unterdrückung erlaubt Aktivität
Die Forscher überprüften ihr Modell in verschiedenen Zellkultur-Experimenten. Neben männlichen und weiblichen Zellen verwendeten sie dabei auch Zelllinien, in denen drei oder mehr X-Chromosomen vorkommen sowie genetisch modifizierte Zelllinien, in denen Xist künstlich an- oder ausgeschaltet werden kann. Die Gene auf dem X-Chromosom werden durch die lange nicht-kodierende RNA Xist unterdrückt. Nach dem von den Wissenschaftlern entwickelten Modell wird aber Xist selber auch von einem Repressor unterdrückt, der sich auf demselben Chromosom befindet, sodass Xist seine Wirkung nicht entfalten kann. Wenn in einer Zelle also nur ein X-Chromosom vorkommt, sind die darauf vorhandenen Gene aktiv. Wenn sich dagegen zwei X-Chromosomen in einer Zelle befinden, liegt auch der in trans wirkende Xist-Aktivator in doppelter Dosis vor. Dies führt dazu, dass seine Wirkung stärker ist, als die des Xist-Repressors. Xist kann also aktiv werden und die Gene auf dem betreffenden X-Chromosom werden stillgelegt. Dies schließt auch den dort vorhandenen trans-Aktivator für Xist mit ein, so dass dieser nicht auf das zweite X-Chromosom rückwirken und dieses ebenfalls inaktivieren kann.
„Interessanterweise kann dieses Modell auch die Aktivierungsmuster der X-Chromosomen bei Menschen mit Turner- oder Klinefelter-Syndrom erklären“, sagt Schulz. Das Turner-Syndrom ist eine bei Frauen auftretende angeborene Erkrankung, bei der die Betroffenen nur ein Geschlechtschromosom besitzen (X0) besitzen. Da nur eine Kopie des trans-Aktivators für Xist vorhanden ist, sind die Gene auf dem vorhandenen X-Chromosom aktiv. Beim Klinefelter-Syndrom weisen die betroffenen Männer neben einem X- und einem Y-Chromosom noch ein zusätzliches zweites X-Chromosom auf. Hier wird wie im weiblichen Organismus eines der beiden X-Chromosomen inaktiviert.
Aber auch die unterschiedlichen Beobachtungen bei der X-Inaktivierung von unterschiedlichen Säugerspezies erklärt das Modell. „Bisher wurde vermutet, dass die Stilllegung des X-Chromosoms bei verschiedenen Spezies über unterschiedliche Mechanismen gewährleistet wird. Die Unterschiede können aber auch durch unterschiedliche Interaktionsstärken zwischen den beteiligten Netzwerkkomponenten entstehen. Wir gehen davon aus, dass die Struktur des Netzwerkes, also dessen grundsätzlicher Aufbau, speziesübergreifend gleich bleibt und dass die Unterschiede eher quantitativer Natur sind“, sagt Schulz.
Originalveröffentlichung
Verena Mutzel, Ikuhiro Okamoto, Ilona Dunkel, Mitinori Saitou, Luca Giorgetti, Edith Heard, Edda G. Schulz; "A symmetric toggle switch explains the onset of random X inactivation in different mammals"; Nature Structural and Molecular Biology; 2019 [Epub ahead of print]