Medikamente aus Bruchstücken: Neues Screening Verfahren für Krebswirkstoffe basiert auf Kristallstrukturanalyse
Einsatz in EU-Forschungsprojekt Growthstop und Oncotyrol geplant
Medizinische Wirkstoffe bestehen in der Regel aus etwa 30 Atomen, Wasserstoff nicht mitgerechnet. Daraus ergeben sich etwa 1.060 theoretisch mögliche chemische Kombinationen. Welche davon sind am besten geeignet, ein therapeutisches Zielmolekül zu blockieren? Vor dieser Frage stehen Pharmafirmen beim Drug Screening. Sie durchforsten riesige „Bibliotheken“ chemischer Substanzen auf der Suche nach Treffern, sogenannten Hits, die an das Zielmolekül binden. Die Zielmoleküle, die es auf diese Weise auszuschalten gilt, sind beispielsweise für die Krebsentstehung verantwortlich.
Obwohl in Hochdurchsatzverfahren mehr als 100.000 chemische Verbindungen pro Tag auf ihre Fähigkeit ans Zielmolekül zu binden getestet werden, kommen doch nur wenige wirklich neuartige Wirkstoff-Moleküle letztlich auf den Markt. Das chemische Universum an kombinatorischen Möglichkeiten bleibt nahezu unerforscht und ungenutzt. Ein neues Verfahren namens Fragment Based Drug Discovery soll hier Abhilfe leisten. Die Münchner Firma Crelux setzt dieses Verfahren im Rahmen des europäischen Krebsforschungsprojekts Growthstop ein und plant eine Partnerschaft mit dem Innsbrucker Zentrum für personalisierte Krebsforschung Oncotyrol. Sowohl Growthstop als auch Oncotyrol werden von der Innsbrucker Firma CEMIT gemanagt.
Bei den herkömmlich verwendeten Hochdurchsatzverfahren setzen große Pharmafirmen ihre chemischen Bibliotheken ein, die viele patentgeschützte Strukturen enthalten - das ist einer der Gründe, warum oft ähnliche Treffer gefunden werden. Diese Substanzen sind oftmals so gewählt, dass sie in kleine, enge Substrat-Bindungstaschen der Zielmoleküle passen. Der Wirkstoff soll gewissermaßen das Schlüsselloch des Zielmoleküls verstopfen, so dass der Schlüssel nicht mehr hineinpasst und die Funktion ausfällt. Bei vielen Krankheitsprozessen spielen aber großflächige Protein-Protein-Bindungen eine Rolle, die mit anderen Substanzen blockiert werden müssen als die kleinen engen Substrat-Bindungstaschen. Geeignete Strukturen fehlen oft in den herkömmlichen chemischen Bibliotheken.
Zudem besteht eine Schwierigkeit darin, dass die im Screen gefundenen Treffer-Moleküle im Laufe der weiteren Entwicklung durch Anhängen chemischer Gruppen modifiziert werden müssen, zum Beispiel um zielgerichtet auf ein bestimmtes Organ zu wirken. Der chemischen Optimierung sind dabei Grenzen gesetzt: Wird das Molekül zu groß, kann es der Körper nicht mehr aufnehmen.
Im Gegensatz zu den gängigen Hochdurchsatzverfahren, werden beim neuen Fragment Based Drug Dicovery-Verfahren nur kleine Molekülbruchstücke gescreent. Diese sind zwar als Wirkstoffe in der Regel ungeeignet, da sie nur schwach an das Zielmolekül binden. Aber weil sie sehr klein sind, ist noch viel Spielraum für chemische Optimierung vorhanden - solange bis das Molekül ideal passt und stark bindet. Crelux setzt zunächst eine neue und sehr empfindliche Analysemethode ein, mit der auch schwach bindende Treffer-Moleküle aufgespürt werden können. Diese werden dann gemeinsam mit den Zielmolekülen kristallisiert. Die Kristallstrukturanalyse liefert dann ein dreidimensionales Bild von der räumlichen Umgebung der aneinander bindenden Moleküle. Die genaue Kenntnis der Struktur erlaubt es, den noch unfertigen Wirkstoff „architektonisch maßgeschneidert“ aufzubauen. So entstehen ganz neue chemische Strukturen, die auch die bisher vernachlässigten Protein-Protein-Wechselwirkungen blockieren können. Sie haben entsprechend innovatives therapeutisches Potenzial - und sie sind in der Regel noch nicht patentiert und daher vermarktbar.
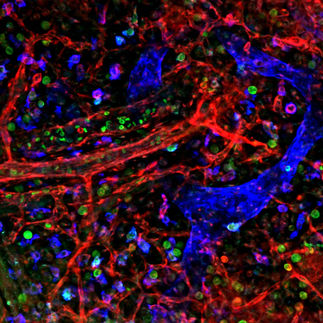
Im Rahmen des europäischen Forschungsprogramms Growthstop versucht ein internationales Wissenschaftler-Konsortium, das ungehemmte Wachstum von Tumorzellen zu stoppen und natürliche Schutzmechanismen wiederherzustellen. Das Konsortium wird von Prof. Lukas A. Huber vom Biozentrum der Medizinischen Universität Innsbruck geleitet. Seine Arbeitsgruppe sucht nach Inhibitoren für MAP-Kinasen (Mitogen-activated protein kinase). Diese bilden eine Signalkette, die Wachstumssignale innerhalb der Zelle weiterleitet. Wie eine umfallende Dominokette, aktiviert eine MAP-Kinase die nächste, bis das Signal am Zellkern angelangt ist. Dort wird dann das Signal in eine Aktion umgesetzt, beispielsweise Zellteilung. Eine übermäßige Aktivierung des MAP-Kinase-Signalwegs führt zu ungehemmtem Wachstum und ist an der Entstehung vieler Tumore beteiligt. Mitglieder der MAP-Kinase-Signalkette sind daher interessante Zielmoleküle für Krebstherapeutika.
Viele Wirkstoff-Entwicklungen auf diesem Gebiet sind bisher allerdings nicht spezifisch genug. Sie setzen an Strukturen an, die nicht nur in Krebszellen und nicht nur im Tumorgeschehen vorkommen. Dadurch kommt es zu unerwünschten Nebeneffekten. Das Team von Lukas Huber beschäftigt sich daher mit einem neuartigen Ansatz: Die Wissenschaftler wollen den Signalweg räumlich und zeitlich begrenzt blockieren: Sie zielen auf den Gerüstproteinkomplex p14/MP1 ab, der die MAP-Kinasen nur zu einem bestimmten Zeitpunkt und an einem bestimmten Ort der Zelle bindet. Hemmt man die Bindung der MAP-Kinasen an diese Gerüstproteine, kann man die Signalkette zielgerichtet modulieren, anstatt sie überall zugleich auszuschalten.
Im Rahmen von Growthstop haben die Wissenschaftler um Huber in Zusammenarbeit mit Vichem Research Ltd., Budapest, und anderen Partnern bereits 19 Treffer-Substanzen gefunden, die nun im Rahmen von Oncotyrol weiter untersucht werden. Mit Hilfe des von Crelux entwickelten Fragment Based Drug Discovery Verfahren und in Zusammenarbeit mit Vichem wollen die Wissenschaftler weitere Treffer finden. Auch sollen die bisher gefundenen Moleküle und ihre Bindung an den Gerüstkomplex p14/MP1 eingehender analysiert und die gefundenen Moleküle mit den Firmenpartnern optimiert werden - um einen Schritt voran zu kommen auf dem Weg von einem ersten Treffer zum therapeutischen Wirkstoff.