Der „TRiC” bei der Aktinfaltung
Damit Proteine ihre Aufgaben in Zellen wahrnehmen können, müssen sie richtig gefaltet sein. Molekulare Assistenten, sogenannte Chaperone, unterstützen Proteine dabei, sich in ihre funktionsfähige, dreidimensionale Struktur zu falten. Während die meisten Proteine sich bis zu einem bestimmten Grad ohne Hilfe falten können, haben Forscher am Max-Planck-Institut für Biochemie nun gezeigt, dass Aktin komplett von den Chaperonen abhängig ist. Aktin ist das am häufigsten vorkommende Protein in höher entwickelten Zellen. Das Chaperon TRiC wendet einen bislang noch nicht beschriebenen Mechanismus für die Proteinfaltung an.
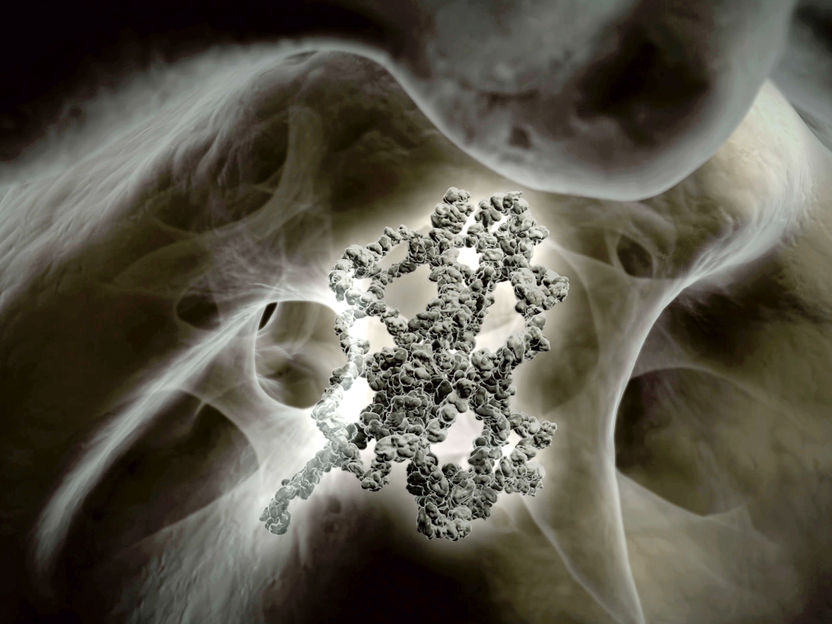
Die Aktin-Aminosäurekette (Mitte) wird im Hohlraum des Chaperonins TRiC in die korrekte 3D-Struktur gefaltet.
© Max-Planck-Gesellschaft
Bei Aktin handelt es sich um das am häufigsten vorkommende Protein in höher entwickelten Zellen, das bei Prozessen wie Zellstabilisation, Zellteilung und Muskelkontraktion unterschiedliche Funktionen ausübt. Wie alle Proteine wird Aktin an den Ribosomen „geboren“. Dies sind die Proteinfabriken der Zellen, die Aminosäuren zu einer langen Kette zusammenfügen. Neu synthetisierte Proteine an den Ribosomen sind noch nicht in der Lage, ihre molekularen Funktionen in der Zelle auszuüben. Um ihre volle Aktivität zu erreichen, müssen sie zunächst die richtige dreidimensionale Faltung annehmen. Bislang glaubte man, dass nicht nur die Information fuer die fertig gefaltete Struktur eines Proteins, sondern auch die Anleitung für den Faltungsweg in der Aminosäuresequenz kodiert sind. Forscher der Abteilung „Zelluläre Biochemie“ des MPIB-Direktors F.-Ulrich Hartl haben nun nachgewiesen, dass dies für das universale Protein Aktin nicht der Fall ist.
Chaperone helfen bei der Proteinreifung
Kinder verfügen bereits bei der Geburt über die natürliche Fähigkeit, sich zu Erwachsenen zu entwickeln. Ihr Reifungsprozess benötigt Zeit und wird durch die elterliche Fürsorge unterstützt. Institutionen wie der Kindergarten helfen Kindern, diesen Prozess sicher zu durchlaufen, indem sie sie von schädlichen Einflüssen fernhalten. Neu-synthetisierte Proteine werden von Chaperonen, molekularen Faltassistenten, vor intermolekularen Wechselwirkungen geschützt, die ihre Faltung behindern würden. Falsch gefaltete Proteine können toxische Klumpen bilden, die Zellen beschädigen und zur Entwicklung von Alzheimer und Parkinson beitragen. Obwohl sich Proteine auch in ihrer Abwesenheit falten können, unterstützen Chaperone daher die Zellgesundheit, indem sie die Effizienz der Faltung verbessern.
Anders als alle bislang untersuchten Proteine kann Aktin seine Faltung nicht ohne das Chaperonin TRiC erwerben. „In der Regel finden Proteine ihre Faltung spontan – Chaperone unterstützen sie lediglich dabei, indem sie den Prozess effizienter machen und das Protein vor Wechselwirkungen bewahren, die ihre Faltung behindern würden. Doch bei Aktin liegt der Fall anders – es benötigt unbedingt die molekulare Falthilfe von TRiC. Aktin ist wie ein Kind, das nie ein reifer Erwachsener wird, wenn es nicht den TRiC-Kindergarten besucht“, sagt der Erstautor der Studie David Balchin.
Im Vergleich zu ähnlichen Proteinen, die das Zytoskelett von Bakterien – evolutionär älteren und einfacheren Zellen – bilden, fanden die Forscher grundlegende Unterschiede bei der Proteinfaltung. „Aktin verfügt über viel mehr Proteininteraktionspartner als die bakteriellen Zytoskelettproteine, hat aber seine Fähigkeit zur eigenständigen Faltung verloren. Es scheint, als ob dieser molekulare Kompromiss die Vielseitigkeit des Aktins ermöglicht“, so Balchin. Durch die Koevolution von TRiC und Aktin konnte Aktin die Verantwortung für die Proteinfaltung an das Chaperonin „outsourcen”.
Die Struktur führt zur Funktion
Die Organisation von Bakterienzellen ist weniger komplex als die höher entwickelter Zellen. Bakterielle Zytoskelettproteine benötigen zum effizienten Erreichen eines Faltzustands ebenfalls die Hilfe von Chaperonen. Einfachere Chaperone, wie man sie in Bakterien findet, können Aktin nicht in seine reife Form falten. Die Forscher klärten die Proteinstruktur von TRiC auf, um seine Funktion zu untersuchen, und stellten fest, dass es über einen speziellen Wirkmodus für die Aktinfaltung verfügt. Während bakterielle Chaperone sieben identische Untereinheiten umfassen, besteht TRiC aus acht unterschiedlichen Untereinheiten. Diese Untereinheiten bilden einen Hohlraum, in dessen Inneren das Aktin gefaltet wird. „Während der Aktinfaltung verändert sich auch die TRiC-Struktur. Wir stellten eine asymmetrische Bewegung des Chaperons fest, die von der Bindung und Lyse des Energie transportierenden Moleküls ATP koordiniert wird. Dieser Vorgang ist weitaus komplexer als die bislang bekannte chaperonunterstützte Proteinfaltung.“
In der Studie zu Aktin wird erstmals ein sich nicht selbst faltendes Protein beschrieben. „Die Proteineigenschaften betreffend betreten wir mit unserer Studie Neuland“, sagt MPIB-Direktor F.-Ulrich Hartl. Der Nachweis dieser außergewöhnlichen Chaperonabhängigkeit bricht mit dem Dogma, dass alle Proteine in ihrer Aminosäuresequenz über die natürliche Fähigkeit zur Faltung verfügen. „Aktin“, fügt Hartl hinzu, „ist nur ein Beispiel für Proteine, die durch TRiC gefaltet werden, wenn auch ein sehr prominentes. TRiC fungiert jedoch als Chaperon für etwa zehn Prozent aller Proteine. Wir fangen gerade erst an zu verstehen, welche Auswirkungen diese spezielle Unterstützung bei der ‚Proteinbetreuung‘ auf die Zellen hat.“
Originalveröffentlichung
D. Balchin, G. Milicic, M. Strauss, M. Hayer-Hartl, F.-U. Hartl; "Pathway of Actin Folding Directed by the Eukaryotic Chaperonin TRiC"; Cell; August 2018