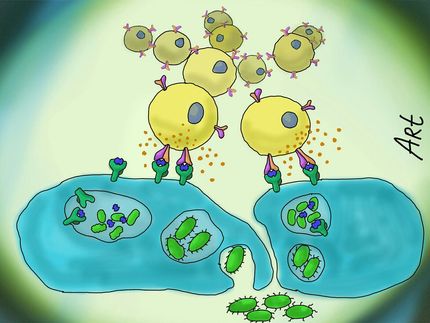
Im Kampf gegen Bakterien braucht es genügend Energie
Um Bakterien und Pilze einzufangen und abzutöten, bauen weisse Blutkörperchen Netze aus DNA und toxischen Proteinen. Diese «Fangnetze» unseres Immunsystems sind nur dank einer zusätzlichen Energiequelle in diesen Abwehrzellen möglich, wie Forschende der Universität Bern herausfanden.
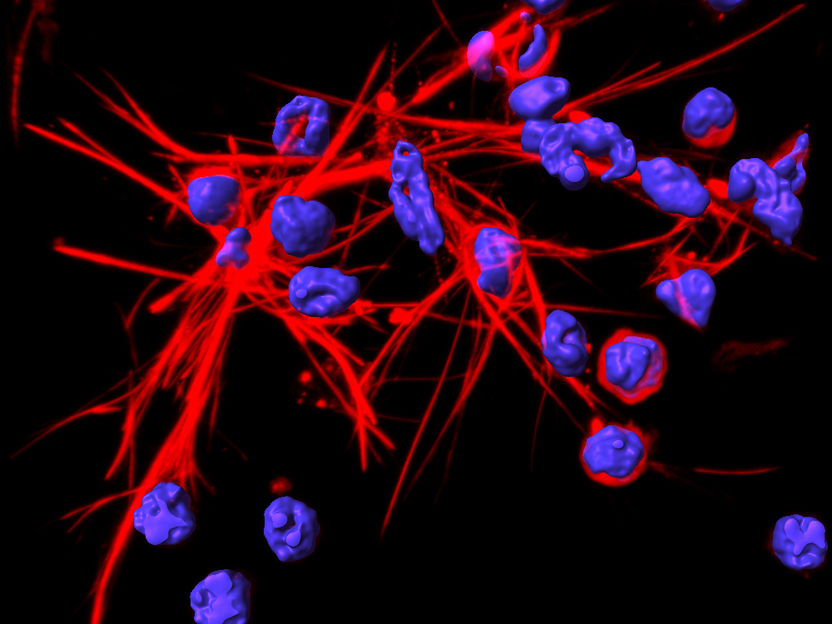
DNA-Netze (rot), die durch Neutrophile aufgestellt werden.
Institut für Pharmakologie/UniBE
Neutrophile Granulozyten, kurz Neutrophile, sind eine bestimmte Art von weissen Blutkörperchen. Sie sind die am häufigsten vorkommenden Zellen unseres natürlichen Abwehrsystems und für die Abtötung von Bakterien und Pilzen zuständig. Ist die Zahl der Neutrophile zu tief oder deren Funktion eingeschränkt, drohen lebensgefährliche Infektionen. Nun hat eine Forschungsgruppe der Universität Bern unter der Leitung von Hans-Uwe Simon vom Institut für Pharmakologie herausgefunden, dass Neutrophile zur Abtötung von Bakterien auf eine intakte Struktur ihrer Mitochondrien, den sogenannten «Kraftwerken der Zellen», angewiesen sind. Dabei spielt ein spezielles Protein, das Optic Atrophy 1 (OPA1) Protein, eine wichtige Rolle.
Bisher nahm man an, dass die in Neutrophilen nur wenig vorhandenen Mitochondrien keine besondere Bedeutung haben und lediglich für das natürliche Absterben dieser Zellen zuständig sind. Wie die Studie nun zeigt, erfüllen die Mitochondrien in Neutrophilen eine zentrale Funktion für die gesamte Immunabwehr. Die Studie ist eine Zusammenarbeit der Institute für Pharmakologie und Klinische Chemie der Medizinischen Fakultät sowie dem Departement für Infektionskrankheiten und Pathobiologie der Vetsuisse-Fakultät der Universität Bern, der Kinderklinik des Inselspitals und weiteren Forschungsgruppen aus dem In- und Ausland.
Eine Extraportion Energie
Neutrophile verfolgen eine besonders raffinierte Strategie, um Bakterien zu eliminieren: sie spannen Netze aus DNA und toxischen Proteinen in der Blutbahn und im Gewebe. So können sie die Bakterien einfangen und abtöten. Die Forschenden wollten herausfinden, wie dieser Prozess abläuft und untersuchten dazu das OPA1-Protein in den Mitochondrien der Neutrophile. Sie konnten nachweisen, dass dieses Protein nicht nur die Form der Mitochondrien, sondern auch deren Funktion bestimmt. Das OPA1-Protein in den Mitochondrien der Neutrophile sorgt dafür, dass genügend NAD+ (Nicotinamid Adenin Dinukleotid) zur Verfügung steht – ein zentrales Molekül, um im Zellplasma zusätzliche Energie zu generieren.
Die Gruppe um Hans-Uwe Simon konnte experimentell zeigen, dass diese Energie notwendig ist, um DNA aus den Mitochondrien in die Umgebung freizusetzen und DNA-Netze zur Abwehr von Infektionen zu bilden. «Wir konnten nachweisen, dass Mitochondrien in Neutrophilen eine sehr spezielle Funktion haben, und dass das Protein OPA1 für unser Immunsystem von grundlegender Bedeutung ist», sagt Hans-Uwe Simon. Aus diesen Beobachtungen leiten die Forschenden neue Therapieansätze zur Behandlung von Infektionskrankheiten ab, bei denen das OPA1- Protein in Neutrophilen gezielt aktiviert werden könnte.
Originalveröffentlichung
Poorya Amini, Darko Stojkov, Andrea Felser, Christopher B. Jackson, Carolina Courage, André Schaller, Laurent Gelman, Maria Eugenia Soriano, Jean-Marc Nuoffer, Luca Scorrano, Charaf Benarafa, Shida Yousefi, and Hans-Uwe Simon; "Neutrophil extracellular trap formation requires OPA1-dependent glycolytic ATP production"; Nature Communications; 27. Juli 2018
Originalveröffentlichung
Poorya Amini, Darko Stojkov, Andrea Felser, Christopher B. Jackson, Carolina Courage, André Schaller, Laurent Gelman, Maria Eugenia Soriano, Jean-Marc Nuoffer, Luca Scorrano, Charaf Benarafa, Shida Yousefi, and Hans-Uwe Simon; "Neutrophil extracellular trap formation requires OPA1-dependent glycolytic ATP production"; Nature Communications; 27. Juli 2018
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.