Durchbruch für Peptid-Medikamente
Der „heilige Gral“ der Peptidchemie: Neue Strategie macht Peptid-Wirkstoffe oral verfügbar
Anzeigen
Peptide, kurze Ketten aus Aminosäuren, die im menschlichen Körper viele Funktionen steuern, stehen auch in der Pharmazie für einen Milliardenmarkt. Üblicherweise müssen diese Medikamente jedoch gespritzt werden. Wie man Peptide so gestalten kann, dass sie einfach als Saft oder Tablette eingenommen werden können, hat nun ein von der Technischen Universität München (TUM) angeführtes Forschungsteam herausgefunden.
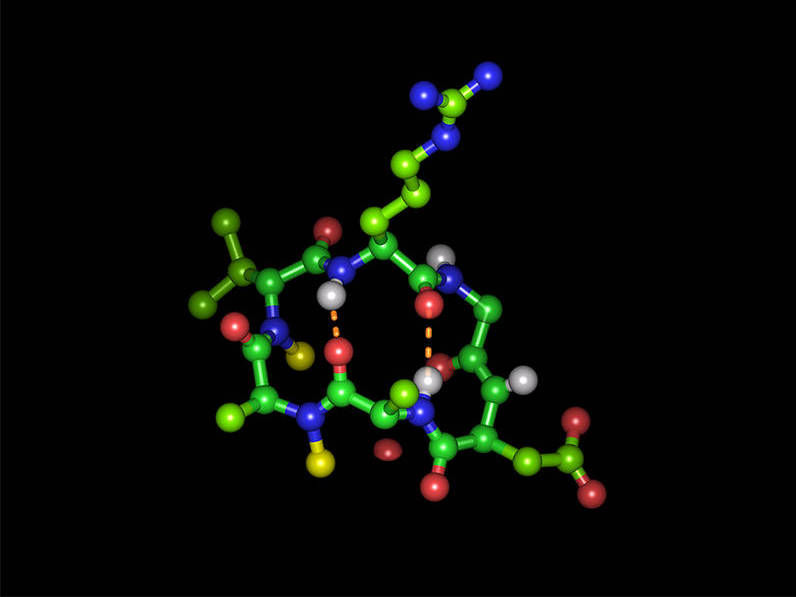
Cyclisches Hexapeptid in seiner bioaktiven Form mit der Integrin-bindenden Tripeptidsequenz Arginin-Glycin-Asparaginsäure: Grüne Kugeln stellen Kohlenstoff-Atome, rote Sauerstoff-Atome, blaue Stickstoff-Atome und weiße Wasserstoff-Atome dar. Die beiden N-Methylgruppen sind als gelbe Kugeln abgebildet und die zwei intramolekularen Wasserstoff-Brückenbindungen als gestrichelte orangenen Linien. Anordnung (im Uhrzeigersinn): Arginin (oben), Glycin, Asparaginsäure, Alanin, N-methyliertes Alanin, N-methyliertes D-Valin.
Michael Weinmueller / TUM
Peptide sind kurze Aminosäureketten. Im menschlichen Körper steuern sie als Signalmoleküle vielfältige Funktionen. Bekannte Beispiele sind das Insulin, das aus 51 Aminosäurebausteinen besteht und den Zuckerstoffwechsel steuert oder Cyclosporin, ein Peptid aus elf Aminosäuren, das sich zur Unterdrückung der Abstoßungsreaktion bei Organtransplantationen bewährt hat.
„Peptide eignen sich wunderbar als Medikamente“, sagt Horst Kessler, Carl von Linde Professor am Institute for Advanced Study der TU München. „Der Körper nutzt sie ja bereits als Signalmoleküle, und wenn sie ihre Aufgabe erfüllt haben, können sie vom Körper recycelt werden – keine Anreicherung, keine aufwändige Entgiftung.“
Weltweit befinden sich daher derzeit rund 500 Peptid-basierte Medikamente in klinischen Tests. Einige wenige Peptid-Medikamente erzielen bereits Milliardenumsätze. Doch dass sie nicht in Tablettenform eingenommen werden können, ist ein entscheidender Nachteil fast aller Substanzen dieser Klasse.
Hürdenlauf
Da Eiweiße ein wichtiger Bestandteil der Nahrung sind, gibt es in Magen und Darm unzählige Enzyme, die Peptidbindungen spalten. Ungeschützt würde kein Peptid-Medikament den Durchgang durch den Magen-Darm-Trakt überstehen.
„Hier haben wir in den letzten Jahren einige wirksame Strategien entwickelt: Schwerer angreifbar sind beispielsweise ringförmige Peptide. Die Amidgruppen können mit Methylgruppen geschützt werden, und auch der Einbau von spiegelverkehrt aufgebauten D-Aminosäuren erschwert den Angriff der Verdauungsenzyme“, erläutert Kessler.
Doch kommen solchermaßen modifizierte Peptid-Verbindungen heil durch den Magen, steht ihnen eine weitere Hürde im Weg: Die Zellen der Darmwand verwehren ihnen die Aufnahme ins Blut. Spritzen ist daher in der Regel der einzige Weg, solche Wirkstoffe in den Körper zu bringen.
Der Weg durch die Wand
Diese Herausforderung ging das Team zunächst mit einem ringförmigen Modellpeptid an. Es bestand aus sechs Molekülen der einfachsten Aminosäure, dem Alanin. Damit untersuchten die Wissenschaftler, wie sich der Ersatz von Wasserstoffatomen der Peptidbindungen durch Methylgruppen auf die orale Verfügbarkeit auswirkt.
Über 50 Variationen kamen so zustande. Zellversuche der Kooperationspartner in Israel zeigten, dass nur ganz bestimmte Peptid-Varianten sehr schnell aufgenommen werden. „Es sieht so aus, als könnten zyklische Hexapeptide mit einer bestimmten Struktur ein vorhandenes Transportsystem nutzen“, sagt Prof. Kessler.
Die biologische Wirkung
Als Ziel für ihre Peptide wählte des Team Integrin-Rezeptoren, die an der Zelloberfläche vielfältige Funktionen steuern. Eine Sequenz aus den drei Aminosäuren Arginin, Glycin und Asparaginsäure ist der Schlüssel für die Erkennung an diesen Rezeptoren. Kesslers Mitarbeiter bauten die Schlüsselsequenz an verschiedenen Positionen ihres Modellpeptids ein und schufen so neue Varianten.
Doch sowohl die negativ geladene Seitenkette der Asparaginsäure als auch das positiv geladene Arginin stellten sich als KO-Kriterium für die Nutzung des Transportsystems heraus. Dem Team gelang es jedoch, die geladenen Gruppen beider Aminosäuren mit Schutzgruppen zu maskieren.
Zwar verliert das Peptid damit zunächst die Fähigkeit zur Bindung an das Zielmolekül, doch wählt man die richtigen Schutzgruppen, so werden diese durch im Blut allgegenwärtige Enzyme wieder abspalten. Am Ziel angekommen ist die pharmazeutische Wirkung wiederhergestellt.
Beweis der oralen Verfügbarkeit
Zelltests bestätigten, dass das neue Hexapeptid eine biologische Wirkung aufweist: In niedriger Dosierung regt es das Wachstum von Blutgefäßen an. Füttert man Mäuse mit dem maskierten Hexapeptid, so stellt sich die gleiche Wirkung ein, wie bei Mäusen, denen das unmaskierte Hexapeptid gespritzt wurde.
„Experten haben in der Vergangenheit die orale Verfügbarkeit peptidbasierter Medikamente als den „heiligen Gral der Peptidchemie“ bezeichnet. Mit unserer Arbeit liefern wir eine Strategie, wie die Herausforderungen der Stabilität, der Aufnahme in den Körper und der biologischen Wirksamkeit gelöst werden können“, sagt Kessler. „In Zukunft wird es damit sehr viel leichter, Peptid-Medikamente herzustellen, die einfach als Saft oder Tablette gegeben werden können.“
Originalveröffentlichung
"Overcoming the lack of oral availability of cyclic hexapeptides: Design of a selective and orally available ligand for the integrin alphaVbeta3"; Michael Weinmüller et al.; Angewandte Chemie International Edition; 18.12.2017, 56, 16405-16409
"Improving oral bioavailability of cyclic peptides by N-methylation"; Andreas F. B. Räder, Florian Reichart, Michael Weinmüller, Horst Kessler; Bioorganic & Medicinal Chemistry; 2017, in press
"Exploring the Role of RGD-Recognizing Integrins in Cancer"; Markus Nieberler, Ute Reuning, Florian Reichart, Johannes Notni, Hans-Jürgen Wester, Markus Schwaiger, Michael Weinmüller, Andreas Räder, Katja Steiger and Horst Kessler; Cancers; 2017, 9, 116

























































