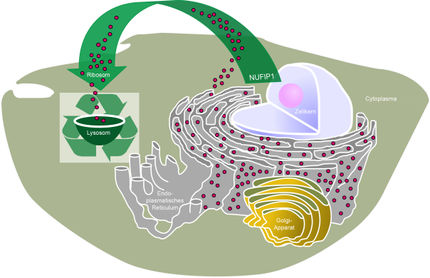
Nanoschalter in der Zelle: Neuer Mechanismus zur Regulation der Proteinsynthese entdeckt
Mitochondrien, am besten bekannt für ihre Rolle als Zellkraftwerke, erfüllen viele lebensnotwendige Aufgaben in der Zelle. In den Mitochondrien können im Rahmen der Zellatmung reaktive Sauerstoffspezies entstehen. Wenn diese im Übermaß vorhanden sind, führen sie aufgrund ihrer hohen Reaktivität zu irreparablen Schädigungen wichtiger Zellbestandteile. Dieser so genannte oxidative Stress steht bei vielen Krankheiten und auch bei Alterungsprozessen im Verdacht, eine ursächliche Rolle zu spielen. In niedrigen Konzentrationen können reaktive Sauerstoffspezies jedoch in der Zelle auch als wichtige Botenstoffe fungieren. Dabei werden spezifische, so genannte redox-aktive Thiole in bestimmten Proteinen modifiziert. Diese Form der oxidativen Modifikation ist umkehrbar und kann wie ein Nanoschalter die Funktion eines Proteins regulieren.
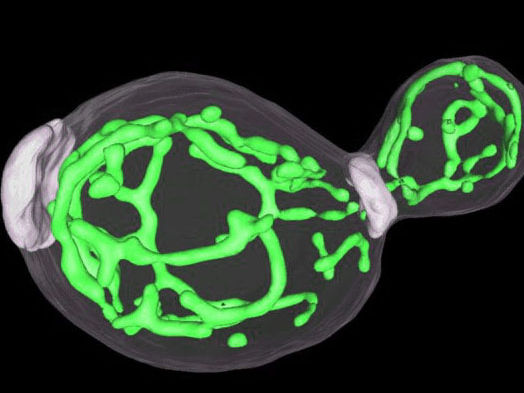
3D-Struktur von Mitochondrien in einer Hefezelle mit Sprossung. Die Markierung mit einem grünfluoreszierenden Protein zeigt, dass Mitochondrien ein dichtes tubuläres Netzwerk in der Zelle bilden.
Stefan Jakobs
Ein deutsch-polnisches Forschungsteam um Prof. Dr. Bettina Warscheid von der Universität Freiburg und Prof. Dr. Agnieszka Chacinska vom Centre of New Technologies in Warschau/Polen hat einen neuen Mechanismus entdeckt, mit dem Mitochondrien, deren Redox-Gleichgewicht geschädigt ist, die Neubildung von Proteinen im Zytoplasma regulieren können. Die Mitochondrien benutzen reaktive Sauerstoffspezies als Signal, um die Proteinsynthesemaschinerie zu verlangsamen.
Zunächst bestimmte Dr. Ida Suppanz aus Warscheids Arbeitsgruppe mittels quantitativer Massenspektrometrie den Redoxzustand von Thiolen in Tausenden von Proteinen der Bäckerhefe Saccharomyces cerevisiae. Dabei entdeckte sie in Komponenten der Ribosomen, an denen die Bildung neuer Proteine stattfindet, bisher unbekannte redox-aktive Thiole.
Ulrike Topf aus Chacinskas Arbeitsgruppe beobachtete, dass ein erhöhter Level an reaktiven Sauerstoffspezies die Neubildung von Proteinen hemmt. Durch biochemische und zellbiologische Methoden zeigte sie, dass geschädigte Mitochondrien ihren Stoffwechselzustand mit Hilfe von reaktiven Sauerstoffspezies an die Proteinsynthesemaschinerie melden und diese dadurch bremsen können.
Es wird angenommen, dass die zeitweise Reduzierung der Proteinsyntheserate bei oxidativem Stress einen positiven Effekt auf das Überleben der Zellen hat, da es vermutlich hilft, das Gleichgewicht in der Zelle wiederherzustellen: Auf diese Weise wird verhindert, dass die Zelle Proteine synthetisiert, die von den geschädigten Mitochondrien nicht aufgenommen werden können, sich folglich im Zytoplasma anstauen und wieder abgebaut werden müssen. Wie die Zelle bei einem Proteinstau reagiert, hat das Team um Warscheid und Chacinska schon 2015 in der Fachzeitschrift „Nature“ dargelegt.
Des Weiteren konnten die Wissenschaftlerinnen zeigen, dass es diesen neu entdeckten Regulationsmechanismus nicht nur in Hefezellen, sondern auch in menschlichen Zellen gibt. Erkenntnisse darüber, wie dysfunktionale Mitochondrien mit anderen Komponenten der Zelle kommunizieren, können helfen, die Mechanismen alterungsbedingter und neurodegenerativer Erkrankungen zukünftig besser zu verstehen.
Originalveröffentlichung
Ulrike Topf*, Ida Suppanz*, Lukasz Samluk, Lidia Wrobel, Alexander Böser, Paulina Sakowska, Bettina Knapp, Martyna K. Pietrzyk, Agnieszka Chacinska# & Bettina Warscheid#; "Quantitative proteomics identifies redox switches for global translation modulation by mitochondrially produced reactive oxygen species"; Nature Communications; 2018 (*#Diese Autorinnen sind zu gleichen Teilen beteiligt.)
Meistgelesene News
Originalveröffentlichung
Ulrike Topf*, Ida Suppanz*, Lukasz Samluk, Lidia Wrobel, Alexander Böser, Paulina Sakowska, Bettina Knapp, Martyna K. Pietrzyk, Agnieszka Chacinska# & Bettina Warscheid#; "Quantitative proteomics identifies redox switches for global translation modulation by mitochondrially produced reactive oxygen species"; Nature Communications; 2018 (*#Diese Autorinnen sind zu gleichen Teilen beteiligt.)
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.