Forscher tricksen Ebolavirus aus
Europäisches Team schafft Grundlagen, um Arzneimittel gegen Erreger der Ebolaseuche zu entwickeln
Ein künstlich hergestellter Hemmstoff bremst die Vermehrung des Ebolavirus; er könnte die Entwicklung eines Arzneimittels ermöglichen, das gegen die lebensbedrohliche Ebolaseuche hilft. Das hofft eine Forschungsgruppe europäischer Wissenschaftler aufgrund von Experimenten, mit denen das Virus daran gehindert wird, ein Enzym der befallenen Zellen für eigene Zwecke zu missbrauchen.
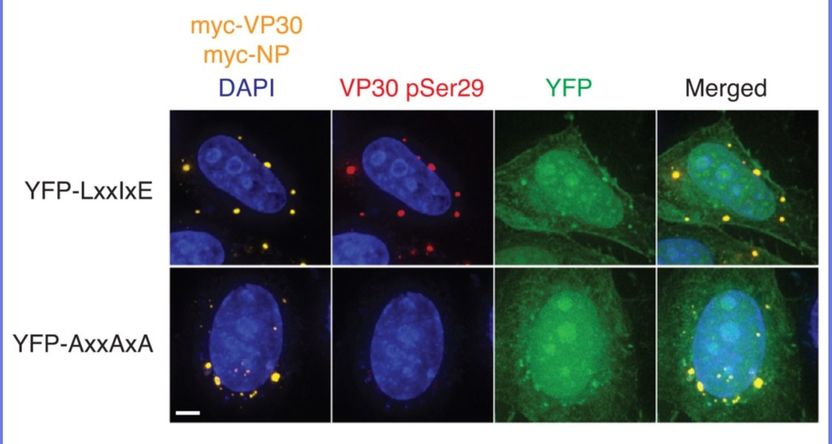
Schleust man in Zellen eine künstliche Kontaktstelle YFP-LxxIxE ein, die anstelle des Nukleoproteins an der zelleigenen Phosphatase andockt (obere Bildreihe), so behält das Virenprotein VP30 seine Phosphat-Anhängsel (rot gefärbt im zweiten Bild oben); diese fehlen (darunter), wenn man eine untaugliche Kontaktstelle einsetzt.
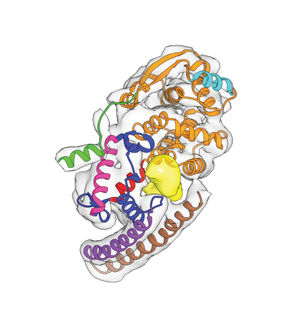
Dr. Thomas Kruse, Novo-Nordisk Foundation Center for Protein Research
Das Ebolavirus löst eine lebensbedrohliche Fiebererkrankung aus, die meist zum Tode führt. „Die größte bekannte Ebolavirus-Epidemie endete im Jahr 2016 in Westafrika, nachdem sie mehr als 11.000 Todesopfer gefordert hatte“, sagt der Virologe Professor Dr. Stephan Becker von der Philipps-Universität Marburg, Seniorautor der neuen Veröffentlichungen; „bislang gibt es kein Heilmittel gegen den Erreger“. In einem Projekt des Deutschen Zentrums für Infektionsforschung (DZIF) tat sich Beckers Marburger Arbeitsgruppe mit Zellbiologen und Biochemikern aus Dänemark und Irland zusammen, um diese Forschungslücke zu schließen. Die Studie eröffnet neue Möglichkeiten, das Ebolafieber zu behandeln, indem sie ein Zielmolekül identifiziert, an dem künftige Therapeutika ansetzen könnten.
Das vireneigene Protein VP30 nimmt eine Schlüsselstellung in der Vermehrung von Ebolaviren ein: Je nachdem, in welcher chemischen Form das Protein vorliegt, fördert es entweder die Vermehrung des gesamten Virenerbguts oder sorgt dafür, dass die einzelnen Virengene abgelesen werden, damit die Genprodukte in Proteine übersetzt werden.
Das Umschalten von der einen Funktion auf die andere erfolgt, indem sich chemische Anhängsel an bestimmte Stellen von VP30 anheften; bei diesen Anhängseln handelt es sich um Phosphatgruppen. Sind die Schlüsselstellen von VP30 dephosphoryliert, also phosphatfrei, werden andere Virusfunktionen aktiviert, als wenn diese Stellen besetzt sind.
Doch wer ist dafür verantwortlich, die Anhängsel anzubringen und wieder zu entfernen? Das war bislang unbekannt. Becker und sein Team zeigen nun, dass die Dephosphorylierung ausgerechnet von einem Enzym der befallenen Wirtszelle besorgt wird, einer Phosphatase mit dem Namen PP2A-B56. Becker spricht vom „Kidnapping“ des Enzyms durch das Virus. Man könnte auch an eine Zwangsverheiratung denken, bei der sich ein weiteres Virusprotein als Kuppler beteiligt: Das Nukleoprotein NP.
Das Nukleoprotein verkuppelt die Phosphatase des Wirts und das Zielmolekül VP30, indem es die beiden in räumlicher Nähe zueinander platziert, wie einen Tischherrn zu seiner Tischdame. Für die zwei Partner gibt es hierfür Kontaktstellen auf dem Nukleoprotein, die einander benachbart liegen. Beide Partner passen zu ihrer Kontaktstelle auf dem Nukleoprotein wie ein Stecker zur Steckdose.
Die und Wissenschaftler führten ausgeklügelte Experimente durch, um zu zeigen, wie die Dephosphorylierung vor sich geht: Das Forschungsteam erzeugte einen molekularen Doppelgänger, der ebensogut in die Andockstelle der Phosphatase passt wie das Nukleoprotein. Der Doppelgänger verdrängt das Nukleoprotein; dadurch kommt es zur Trennung der Zwangspartner VP30 und PP2A-B56. Mit diesem Manöver verhindern die Forscher, dass das Wirtsenzym die Phosphat-Anhängsel vom Virusprotein VP30 entfernt.
Wie die experimentellen Ergebnisse belegen, vermehrt sich das Virus in diesem Fall schlechter, als wenn VP30 mit der Wirts-Phosphatase in Kontakt kommt. Je mehr Phosphatase-Hemmstoff man einsetzt, desto weniger Genprodukte erzeugt das Virus; dadurch wird die Virenvermehrung stark herabgesetzt. „Unsere Befunde zeigen, dass der künstlich hergestellte Phosphatase-Hemmstoff die Infektion durch das Ebolavirus unterdrückt“, führt Beckers Mitarbeiterin Dr. Nadine Biedenkopf aus, eine der Ko-Autorinnen der Publikation.
„Die Hemmung der Phosphatase könnte sich als eine Strategie anbieten, mit der sich eine Ebolavirus-Infektion bekämpfen lässt“, schreiben die Autoren. „Auf der Wirtsseite anzugreifen, bringt den Vorteil mit sich, dass eine Resistenzentwicklung gegen die Hemmung weniger wahrscheinlich ist, als wenn diese sich gegen ein Virenprotein richtet.“ Zwar seien unerwünschte Nebenwirkungen zu erwarten, aber die Ausschaltung wichtiger Protein-Phosphatasen werde bei anderen Erkrankungen bereits seit Jahrzehnten erfolgreich angewendet.
Um neue Hemmstoffe gegen das Ebolavirus testen zu können, hat Beckers Arbeitsgruppe außerdem ein Bildgebungsverfahren etabliert, mit dem sich Bewegungen virenähnlicher Partikel durch lebende Zellen verfolgen lassen. „Auch hiermit soll die Schnittstelle zwischen Virus und Zelle auf mögliche Ziele für antivirale Wirkstoffe untersucht werden“, erläutert Becker.
Originalveröffentlichung
Thomas Kruse, Nadine Biedenkopf, Emil Peter Thrane Hertz & al.; "The Ebola Virus Nucleoprotein Recruits the Host PP2A-B56 Phosphatase to Activate Transcriptional Support Activity of VP30"; Mol. Cell; 2017.
Yuki Takamatsu, Larissa Kolesnikova & Stephan Becker; "Ebola virus proteins NP, VP35, and VP24 are essential and sufficient to mediate nucleocapsid transport"; Proc. Natl. Acad. Sci. USA; 2018