Trügerisches Modell
Stammzellen von Mensch und Maus unterscheiden sich stärker als vermutet - neue Studie stellt Forschungsvorgaben in Frage
Sie gelten als wichtigster Modellorganismus für die Erkundung der menschlichen Biologie: Obwohl Mäuse ganz anders aussehen, ähnelt ihre Grundausstattung der des Homo sapiens in vielerlei Hinsicht. Für beeindruckende 99 Prozent der Maus-Gene etwa gibt es eine entsprechende Sequenz im menschlichen Erbgut. So kommt es auch, dass das Gesetz Wissenschaftlern hierzulande nur erlaubt, mit menschlichen embryonalen Stammzellen zu forschen, wenn sie ihre Fragen so weit wie möglich an tierischen Zellen "vorgeklärt" haben. Doch solche Tests sind häufig nutzlos - und führen mitunter sogar in die Irre, wie eine aktuelle Untersuchung von Forschern um Hans Schöler vom Max-Planck-Institut für molekulare Biomedizin in Münster zeigt.
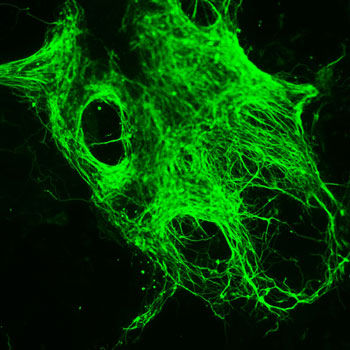
Verwandlung in eine Nervenzelle: Neuronale Differenzierung von Epiblast-Stammzellen der Maus durch Inaktivierung des FGF-Signalweges. Die molekularen Mechanismen der Differenzierung menschlicher oder muriner Stammzellen können sich ähneln, aber unter Umständen auch deutlich unterscheiden.
Boris Greber, Max-Planck-Institut für molekulare Biomedizin, Münster
Seit Jahren rätseln Wissenschaftler, wie weit sich Erkenntnisse aus Untersuchungen an embryonalen Stammzellen (ES-Zellen) von Mäusen auf den Menschen übertragen lassen. Zwar sind sowohl humane als auch Maus-ES-Zellen pluripotent. Das heißt, sie sind in der Lage, jeden der über 200 Zelltypen des Körpers zu bilden. Auch ist in beiden Arten von Zellen zum Beispiel der so genannte Transkriptionsfaktor Oct4 aktiv. Jenes Gen also, das für die Aufrechterhaltung von Pluripotenz unerlässlich ist und sowohl Eizellen als auch embryonale Stammzellen und frühe Embryonen potentiell unsterblich macht.
In anderen Punkten aber, so weiß man seit längerem, unterscheiden sich ES-Zellen von Mensch und Maus ganz erheblich. Bestimmte Signalstoffe zum Beispiel, mit denen man Maus-Zellen dazu anregen kann, sich zu Leber-, Nerven- oder Muskelzellen zu entwickeln, rufen in menschlichen ES-Zellen keine oder ganz andere Wirkungen hervor.
Die Gründe dafür sind noch unklar. 2007 gelang es jedoch zwei Forscherteams, eine viel versprechende, neue Art von pluripotenten Zellen aus Embryonen von Mäusen zu isolieren (s. Brons und Kollegen, Nature 448, 2007). Auch diese so genannten Epiblast-Stammzellen (EpiSC) sind pluripotent. Sie stammen jedoch aus einem späteren Stadium der Embryonalentwicklung: Sie werden nicht (wie ‚klassische’ ES-Zellen) aus einem wenige Tage alten Embryo im Stadium einer Blastozyste gewonnen, sondern aus einem Embryo, der sich gerade in der Gebärmutter eingenistet hat und der als Epiblast bezeichnet wird.
Das Erstaunliche daran: Obwohl Epiblast-Stammzellen in ihrer Entwicklung eigentlich schon einen Schritt weiter sind, schienen sie den ES-Zellen des Menschen stärker zu ähneln als ‚klassische’ ES-Zellen der Maus. Sowohl Epiblast-Stammzellen als auch humane ES-Zellen lassen sich zum Beispiel unter Zugabe eines bestimmten Hormons, dem Wachstumsfaktor FGF2, züchten und in ihrem Alleskönner-Zustand halten. "In der allgemeinen wissenschaftlichen Diskussion wurden Epiblast-Stammzellen der Maus daher humanen ES-Zellen quasi gleich gesetzt", sagt Boris Greber, der Erst-Autor der Studie.
Unterschiedliche Wirkung von Signalmolekülen
Doch der Biochemiker wollte es genauer wissen. Er und seine Kollegen haben deshalb in ihrer jüngsten Studie untersucht, wie Maus-Epiblast- und menschliche embryonale Stammzellen auf verschiedene Wachstumsfaktoren und Hemmstoffe reagieren. Und siehe da: Beide Arten von Zellen unterschieden sich in einem zentralen Punkt. Während der Wachstumsfaktor FGF die Selbsterneuerung der menschlichen ES-Zellen aktiv unterstützte, war dies bei Epiblast-Zellen der Maus eben nicht der Fall.
"Das heißt letztlich, dass viele Voruntersuchungen an tierischen Zellen gerade bei medizinisch relevanten Projekten unter Umständen nicht nur nichts nützen. Die Ergebnisse aus solchen Vorab-Tests können sogar irreführend sein." Auch künftig, so Schöler, seien menschliche ES-Zellen für die Stammzellforschung daher unverzichtbar. "Die jüngsten Erfolge auf dem Gebiet der Reprogrammierung von ausgereiften menschlichen Körperzellen erzeugen mitunter den Eindruck, dass Versuche mit menschlichen ES-Zellen inzwischen überflüssig sind. Aber dieser Eindruck täuscht." Weder die Techniken zur Reprogrammierung noch zur zielgerichteten Differenzierung von Zellen seien bislang ausgereift.
Menschliche Stammzellen bleiben unverzichtbar
Nur ein Bruchteil der Zellen, die die Forscher mit ihren Rezepten behandeln, weist anschließend die richtigen Eigenschaften auf. Und nur durch aufwändige, langwierige Tests lassen sich die erfolgreich umgewandelten Zellen unter einer Vielzahl von unvollständig reprogrammierten Zellen identifizieren. "Unsere jüngste Studie belegt, dass tierische Modellsysteme für etliche solcher Tests unzulänglich sind", sagt Schöler. "Gerade, wenn es darum geht, sichere und wirksame Stammzelltherapien zu entwickeln, werden wir auch künftig humane ES-Zellen als Goldstandard zum Vergleich brauchen. Lange Voruntersuchungen an tierischen Zellen bergen in diesen Fällen die Gefahr, dass wir wertvolle Zeit und Ressourcen vergeuden."
Originalveröffentlichung: Boris Greber, Guangming Wu, Christof Bernemann, Jin Young Joo, Dong Wook Han, Kinarm Ko, Natalia Tapia, Davood Sabour, Jared Sterneckert, Paul Tesar, Hans R. Schöler; "Conserved and divergent roles of FGF signaling in mouse epiblast stem cells and human embryonic stem cells"; Cell Stem Cell, 5. März 2010