Enzym-Design mit Fernwirkung
Mülheimer Chemiker schaffen eine neue Möglichkeit, Enzyme für industrielle Anwendungen zu optimieren
Ingenieure dürften wohl kaum an der Kühlung basteln, wenn sie den Hubraum eines Motors vergrößern wollen. So ähnlich aber gehen Chemiker des Max-Planck-Instituts für Kohlenforschung vor, um ein Enzym für praktische Anwendungen zu optimieren. Sie tauschen zwei Aminosäuren an einer Stelle aus, die von der Bindungstasche des Biokatalysators - dem Ort, an dem die chemische Reaktion abläuft - relativ weit entfernt liegt. Dieser Umbau verändert die Struktur des Enzyms insgesamt so, dass es nun eine größere Zahl unterschiedlicher chemischer Verbindungen umsetzt. Zudem stellt es dabei bevorzugt eines von zwei möglichen Enantiomeren her, die bei einer herkömmlichen Synthese als sogenanntes Racemat anfallen. Sie gleichen sich chemisch völlig, unterscheiden sich aber in ihrem Aufbau wie die linke und rechte Hand. Als medizinischer Wirkstoff eignet sich meist jedoch nur eine der beiden Versionen. Die Max-Planck-Forscher weisen mit Ihrer Arbeit eine neue Route, um Enzyme je nach Bedarf der chemischen oder pharmazeutischen Industrie umzubauen.
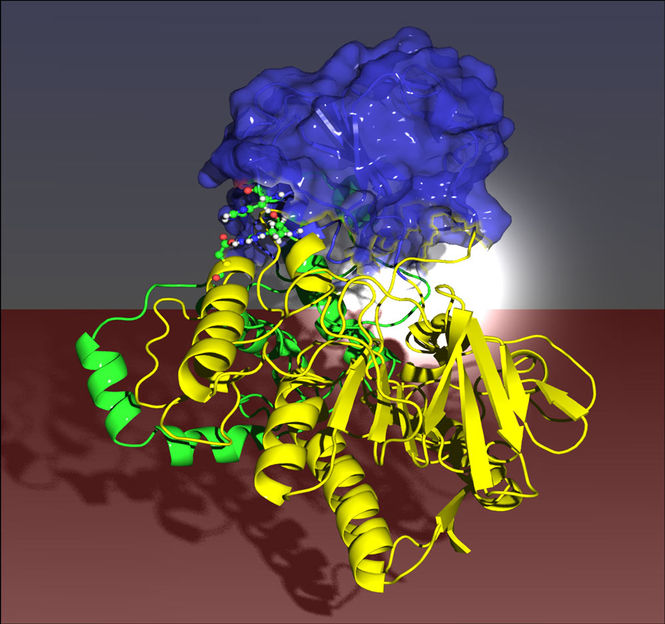
Ein Enzym wird vielseitiger: Mit Hilfe genetischer Veränderungen haben Max-Planck-Chemiker diese Monooxygenase so verändert, dass sie zahlreiche Ausgangsstoffe umsetzt. Zwei Domäne (blau und gelb) werden durch den Austausch zweier Aminosäuren zusammengezogen (links, rote Punkte) mit der Folge, dass sich die ferngelegene Bindungstasche durch einen induzierten allosterischen Effekt vergrößert (rechts, weiß).
MPI für Kohlenforschung
Enzyme arbeiten zwar extrem zuverlässig, sind aber sehr wählerisch. Präzise wandeln sie in der Natur vorkommende Moleküle so um, wie es eine Zelle oder ein Organismus braucht. Oft bauen sie aber nur eine einzige chemische Verbindung um - so als reparierte eine Autowerkstatt nur ein spezielles Fahrzeugmodell. In der Biologie ist das wichtig, da chemische Irrläufer die Maschinerie der Biomoleküle lahmlegen können. Die chemische oder pharmazeutische Industrie braucht aber Katalysatoren, zum Beispiel Enzyme, die auch Moleküle verarbeiten, die in der Natur nicht vorkommen. Häufig geht es dabei um Enantiomere, um zwei täuschend ähnliche Verbindungen, die sich unterscheiden wie die rechte und linke Hand. Chemiker stehen nun vor der Herausforderung, Katalysatoren zu finden, die bei einer Stoffumwandlung nur die eine enantiomere Form entstehen lassen, also enantioselektiv wirken. Manchmal lassen sich Enzyme als Katalysatoren zweckentfremden, um in einer enantioselektiven Synthese Zwischenverbindungen für die Produktion von Medikamenten zu gewinnen. Häufig versagt diese Vorgehensweise jedoch, weil das Enzym nicht dazu befähigt ist, eine enantiomere Form zu erkennen: Nur eines von zwei Enantiomeren soll in der chemischen Reaktion entstehen, denn nur eines zeigt meist die gewünschte biologische Aktivität.
Ein Enzym, das zahlreiche Moleküle enantioselektiv umsetzt, haben Forscher des Max-Planck-Instituts für Kohlenforschung in Mülheim an der Ruhr jetzt mit Hilfe der gerichteten Evolution konstruiert. "Wir betreiben dabei Evolution im Reagenzglas", sagt Manfred T. Reetz, Direktor am Mülheimer Max-Planck-Institut und Leiter der aktuellen Arbeit. Die Chemiker erzeugen also Enzym-Varianten, indem sie deren Struktur durch zufällige Mutationen schrittweise verändern. Zuvor haben sie Enzyme bereits strukturell modifiziert beziehungsweise enantioselektiv gestaltet, indem sie Zufallsmutationen am aktiven Zentrum herbeiführten, dort also, wo die Reaktion abläuft. Nun haben sie eine grundsätzlich andere Strategie entwickelt: Das Enzym wird an einer Stelle umgebaut, die an der eigentlichen Reaktion gar nicht beteiligt ist. "Wir verfolgen damit einen neuen Ansatz der gerichteten Evolution und kombinieren dabei Zufallsmutagenese mit rationalem Design", sagt Manfred Reetz.
Angesetzt haben er und seine Mitarbeiter bei einer natürlichen Baeyer-Villiger Monooxygenase. Dieses Enzym oxidiert ein Ausgangsmolekül, genauer gesagt ein Keton, und baut dabei ein Sauerstoffatom an einer genau festgelegten Stelle ein. Heraus kommt dabei ein Lacton. Enantioselektiv hergestellte Lactone sind begehrte Zwischenverbindungen in der chemischen und pharmazeutischen Industrie.
Die natürliche Form eines Enzyms arbeitet häufig völlig unselektiv, das heißt, es kann nicht zwischen Enantiomeren unterscheiden, weil beide Formen in der Bindungstasche gleich schnell umgesetzt werden. Noch kritischer ist es, wenn das synthetische Molekül erst gar nicht umgesetzt wird, weil es nicht in die Bindungstasche passt. "Um diese Bindungstasche für synthetische Moleküle zu erweitern, haben wir in einem Strukturmodell des Enzyms zunächst eine Stelle gesucht, an der Veränderungen die Bindungstasche umformen, obwohl sie von der Bindungstasche relativ weit entfernt liegt", sagt Juan Pablo Acevedo, der neben Sheng Wu am Umbau des Enzyms maßgeblich mitgearbeitet hat.
Die Stelle, an der ein Aminosäurentausch die gewünschte Wirkung zeigen sollte, vermuteten sie an den Positionen 93 und 94 in der Aminosäurenkette. Aufgrund theoretischer Überlegungen kamen die Chemiker zu dem Schluss, dass geeignete Mutationen dort zu einer strukturellen Umorganisation führen dürften. Mit der Folge, dass zwei Domäne, also zwei Untereinheiten des Enzyms, zusammenrücken: "Unsere Überlegung war, dass sich die Bindungstasche vergrößern müsste, wenn wir diese beiden Domänen enger zusammenziehen", erklärt Juan-Pablo Acevedo. Dies erreichten die Forscher, indem sie die Aminosäuren an den beiden Positionen mit der fokussierten Zufallsmutagenese gleichzeitig durch neue Vertreter ersetzten. Tatsächlich weitete sich die Bindungstasche, als sie auf Position 93 Asparagin anstelle von Glutamin und im Glied 94 Asparginsäure statt Prolin einbauten.
Nun setzte das Enzym mit hoher Aktivität eine ganze Reihe unterschiedlicher Substanzen um, wobei ungewöhnlich hohe Enantioselektivitäten beobachtet wurden. Den Wissenschaftlern ist damit eine Gratwanderung gelungen: Eine größere Bindungstasche öffnet das Enzym zwar für eine breitere Palette an Ausgangsmolekülen, verringert aber meist auch seine Stereokontrolle über die Reaktion, was im vorliegenden Fall nicht eingetreten ist.
Viel wichtiger ist den Forschern aber, dass ihr Ansatz prinzipiell funktioniert: Das Reaktionszentrum umzuformen, indem sie fernab davon eine strukturelle Änderung durch Mutagenese vornehmen. Biochemiker kennen zwar den sogenannten allosterischen Effekt in vielen Enzymen, also eine Umorganisation, mit denen struktureller Änderung der jeweiligen Bindungstasche einhergehen, diese werden jedoch durch kleine Moleküle erzeugt, die sich weit weg von der Bindungstasche an ein Enzym anlagern. "Wir haben mit gentechnischen Methoden einen allosterischen Effekt jetzt in einem Enzym gezielt erzeugt, das eigentlich nicht allosterisch ist", sagt Juan Pablo Acevedo. Ferngelegene Mutationen hatten die Mülheimer Forscher schon früher gelegentlich im Zuge der gerichteten Evolution enantioselektiver Enzyme beobachtet, jedoch ließen sich diese nicht auf allosterische Effekte zurückführen.
Die veränderten Enzyme werden von umprogrammierten Bakterien gebildet. In die Einzeller schleusen die Forscher genetische Baupläne für Varianten eines natürlichen Enzyms ein. In diesen Bauplänen verändern sie an einer oder mehreren Stellen die vorgesehenen Aminosäuren. Statt dabei aber alle 20 Aminosäuren zu testen, aus denen Proteine konstruiert sind, verwenden sie nur zwölf. "Dieser Cocktail repräsentiert sehr gut eine Mischung aus strukturell und elektronisch unterschiedlicher Aminosäuren", erläutert Manfred Reetz. Von der Monooxygenase, die er und seine Mitarbeiter sich nun vorgenommen hatten, gibt es theoretisch 144 Varianten mit verschiedenen Aminosäure-Kombinationen an den Positionen 93 und 94. Um sie tatsächlich alle zu erwischen, müssen die Wissenschaftler aus der Mischung umprogrammierter Bakterien etwa 400 Kolonien züchten, daraus die Enzyme isolieren und auf ihre Eigenschaften testen.
Dabei sind 400 Varianten noch wenig. Wenn die Forscher die Positionen nicht sorgfältig auswählen, an denen Veränderungen Erfolg versprechen, und vielmehr "blinde" Zufallsmutagenese bezogen auf das gesamte Enzym anwenden wie es häufig in der gerichteten Evolution üblich ist, müssten sie vermutlich mindestens mehrere 100.000 Varianten testen - zu viele, als dass die Methode für die chemische oder biotechnologische Industrie praktikabel wäre. "Indem wir rationales Design und Zufallsmutagenese kombinieren, beschleunigen wir die Entwicklung von enantioselektiven und thermostabilen Enzymen sehr", sagt Manfred Reetz. So werden er und seine Mitarbeiter auch bei den nächsten Umbauarbeiten an Enzymen vorgehen. Dann werden sie Veränderungen fernab der Bindungstasche mit einem Umbau am Reaktionszentrum selbst verbinden. "Wir hoffen, dass wir Enzyme dann noch gezielter optimieren können", sagt Manfred Reetz.
Originalveröffentlichung: Sheng Wu, Juan Pablo Acevedo, und Manfred T. Reetz; "Induced allostery in the directed evolution of an enantioselective Baeyer-Villiger monooxygenase"; Proccedings of the National Academy of Sciences, in press