Zellwachstum reguliert genetische Schaltkreise
Max-Planck-Forscher finden Erklärung dafür, warum genetisch identische Zellen unterschiedlich schnell wachsen können
Anzeigen
Genetische Schaltkreise kontrollieren die Aktivität von Genen und damit die Funktion von Zellen und Organismen. Wissenschaftler vom Max-Planck-Institut für Kolloid- und Grenzflächenforschung in Potsdam und der University of California in San Diego zeigen, wie Wachstumseffekte die genetischen Schaltkreise in einer Bakterienzelle beeinflussen. Demnach können Gene auch ohne Regulierung unterschiedlich aktiv sein - je nachdem, ob sie in schnell oder langsam wachsenden Zellen in Proteine übersetzt werden. Mit diesen Ergebnissen können die Forscher besser verstehen, wie Zellen ihre Gene regulieren, und so künftig künstliche genetische Schaltkreise entwickeln.
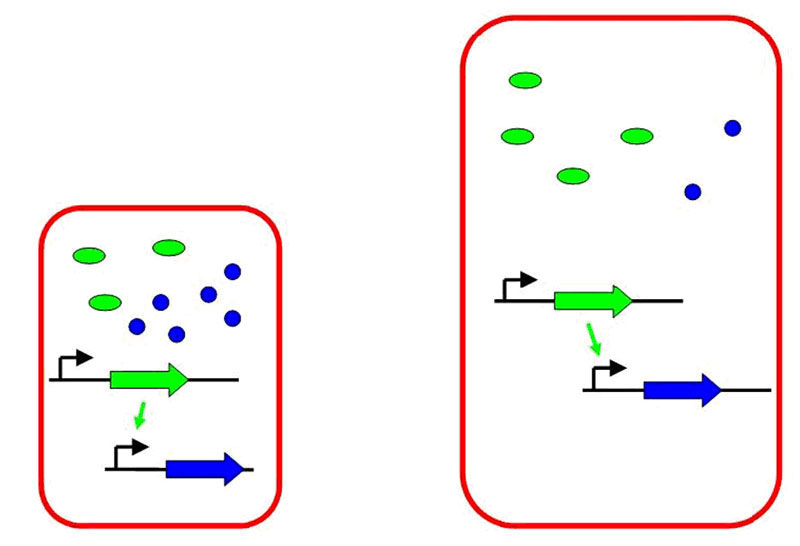
Genetischer Schaltkreis mit positiver Kontrolle in einer bakteriellen Zelle: Das erzeugte Protein eines unregulierten Gens (grün) stimuliert die Produktion des blauen Proteins. Links: Wenn Nährstoffmangel herrscht, ist die Zelle klein und produziert hohe Konzentrationen beider Proteine. Rechts: Bei reichlich vorhanden Nährstoffen wird die Zelle größer, folglich sinkt die Konzentration des Regulators (grün). Er kann deshalb die Produktion des blauen Proteins nicht mehr so stark stimulieren. Dadurch sinkt die Konzentration des blauen Proteins noch deutlicher.
Stefan Klumpp
Schaltkreise kommen nicht nur in CD-Playern, Kaffeemaschinen oder Autos vor, sondern auch in lebenden Zellen - in diesem Fall als "genetische Schaltkreise". Sie bestehen aus einem Netzwerk unterschiedlicher Gene, die sich gegenseitig stimulieren oder hemmen können. Mit Hilfe solcher Schaltkreise kann eine Zelle Gene an- oder abschalten und so kontrollieren, welche Proteine sie produziert. Genetische Schaltkreise hängen jedoch auch von der Zelle als Ganzes ab, die ausreichend Ressourcen für die Bildung von Proteinen zur Verfügung stellen muss. So kann das Standard-Laborbakterium Escherichia coli seine optimale Generationszeit von 20 Minuten auf bis zu einige Stunden ausdehnen, wenn die Nahrung knapp ist. Dies verändert nahezu alle Eigenschaften der Bakterienzellen, wie Größe oder chemische Zusammensetzung.
Proteinkonzentration unregulierter Gene sinkt bei schnellerem Wachstum
Die Wissenschaftler demonstrieren mit einem Theoriemodell sowie einfachen synthetischen genetischen Schaltkreisen in Bakterien, dass die Wachstumsgeschwindigkeit die Aktivität von Genen und damit die genetischen Schaltkreise entscheidend beeinflusst. "Wir haben uns gefragt, wie die Aktivität eines hypothetischen Gens, das überhaupt nicht reguliert wird, vom Wachstum eines Bakteriums abhängt. Dieser Zusammenhang muss nämlich berücksichtigt werden, wenn man in Experimenten eine Änderung der Genexpression feststellt", sagt Stefan Klumpp, Nachwuchsgruppenleiter am Max-Planck-Institut für Kolloid- und Grenzflächenforschung.
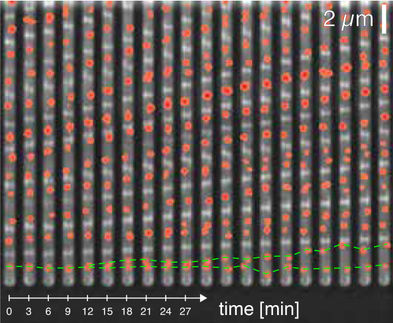
Veränderungen innerhalb der Zelle wirken sich auf mehrere Arten auf die Konzentration an Proteinen aus. So sind in schneller wachsenden Zellen mehr RNA-Polymerasen für die Transkription von Genen vorhanden. Auf diese Weise kann das Gen häufiger ausgelesen werden. Gleichzeitig steht aber weniger Zeit zur Verfügung, um das Protein vor der nächsten Zellteilung anzureichern. Zudem sind schneller wachsende Zellen größer, was bei gleicher Anzahl von Proteinmolekülen eine geringere Konzentration zur Folge hat. Die Wissenschaftler integrierten alle Informationen in ihr theoretisches Modell und konnten so vorhersagen, wie die Wachstumsgeschwindigkeit der Bakterien die Proteinkonzentration beeinflusst. Demnach sinkt die Proteinkonzentration mit steigender Wachstumsrate - ein Ergebnis, das gut mit experimentellen Daten zu unregulierten Genen übereinstimmt.
Dass die Aktivität von Genen und genetischen Schaltkreise davon abhängt, wie schnell die Zellen wachsen, erschwert das Vermessen genetischer Schaltkreise erheblich. Denn die verschiedenen Messgrößen, die für die Charakterisierung der Aktivität von Genen benutzt werden, wie z.B. mRNA- und Proteinkonzentrationen, hängen auf unterschiedliche Weise von der Wachstumsrate ab. "Erhöht sich die Konzentration einer bestimmten Boten-RNA (mRNA) um einen Faktor drei im Vergleich zu einer anderen Messung, geht man normalerweise davon aus, dass die Genexpression hochreguliert wurde" erklärt Stefan Klumpp. "Wenn aber die Zellen mit dem höheren mRNA-Level auch schneller wachsen, könnte sich trotzdem die entsprechende Proteinkonzentration verringert haben." Veränderte Proteinkonzentrationen sind darüber hinaus nicht zwangsläufig eine Folge von regulierter Genexpression. Solche Schwankungen können auch auf verlangsamtes oder beschleunigtes Zellwachstum zurückgehen.
Feedback zwischen regulierten Genen und Zellwachstum
Die Untersuchungen zeigen zudem, wie diese Wachstumseffekte mit der Genregulierung zusammenwirken. Zum Beispiel wird die Proteinkonzentration unabhängig vom Größenwachstum, wenn ein Gen durch negative Rückkopplung kontrolliert wird: In diesem Fall wird die Proteinsynthese gestoppt, wenn eine bestimmte Zielkonzentration erreicht wird. Wächst die Zelle weiter, sinkt die Proteinkonzentration zunächst, so dass weiteres Protein bis zur Zielkonzentration gebildet wird. Das Wachstum von Zellen kann aber auch selbst zu Rückkopplungen führen: Dann nämlich, wenn das Zellwachstum von der Konzentration eines bestimmten Proteins abhängt, die wiederum an das Zellwachstum gekoppelt ist. Wirkt beispielsweise die Proteinkonzentration hemmend auf die Wachstumsrate und stellen langsamer wachsende Zellen gleichzeitig mehr von diesem Protein her (positives Feedback), kann ein Teil einer Population genetisch identischer Zellen schneller wachsen als der Rest. Dies beruht allein darauf, dass ein Zellwachstum hemmendes Protein in manchen Zellen etwas häufiger gebildet wird. Dadurch wachsen diese Zellen langsamer, was wiederum die Konzentration des Proteins steigen lässt und das Wachstum weiter verlangsamt.
Die Forscher nehmen an, dass diese Wachstumseffekte in der Natur aktiv genutzt werden, denn für Bakterien sind sie möglicherweise sogar hilfreich. Wenn sie neue Fähigkeiten erwerben, wie z.B. neue Stoffwechselfunktionen oder Toleranz gegenüber Antibiotika, können die neuen Eigenschaften auch ohne direkte Genregulierung allein durch die Wachstumseffekte reguliert werden. Daraus könnte sich dann ein regulativer Schaltkreis entwickeln.
Originalveröffentlichung: Stefan Klumpp, Zhongge Zhang, Terence Hwa; "Global growth-rate dependent effects on gene expression in bacteria"; Cell 139, 1366-1375 (2009).