Chemiker findet neuen Ansatz für die Entwicklung von Medikamenten
Ein fundamentales Prinzip, das seit Jahrzehnten in der Pharmabranche gilt, in Frage gestellt hat eine Erkenntnis des Leiters des Institutes für Organische Chemie der TU Graz, Rolf Breinbauer, gemeinsam mit Kollegen des Max-Planck-Instituts für Molekulare Physiologie in Dortmund sowie der Universität Leipzig: Sie entdeckten einen neuen Bindungstypen, der beide Spiegelbilder eines Wirkstoffs aufnehmen kann. Die Ergebnisse ihrer Arbeit mit Relevanz für die Entwicklung von Medikamenten veröffentlichten die Forscher in "Angewandte Chemie".
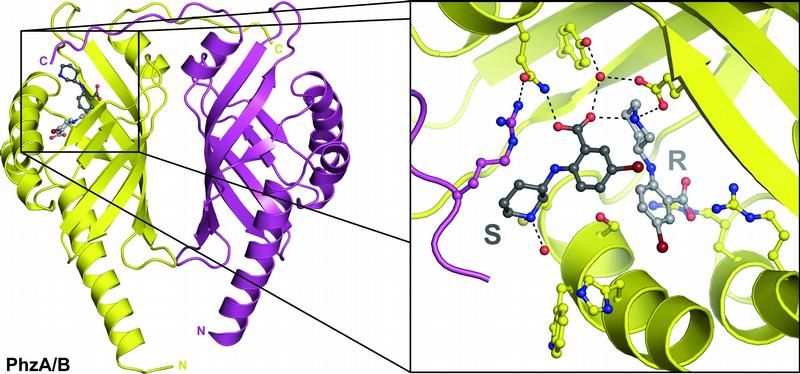
Die Röntgenstruktur des Proteins zeigt beide Enantiomere (R und S) in der Bindungstasche des Enzyms.
Dr. Wulf Blankenfeldt, MPI für Molekulare Physiologie
Das Wissen von heute ist der Irrtum von morgen, heißt es - Rolf Breinbauer, Leiter des Instituts für Organische Chemie der TU Graz, hat das gemeinsam mit seinen zwei deutschen Kollegen eindrucksvoll bewiesen. Hinter dem Titel ihrer Publikation "Gleichzeitige Bindung beider Enantiomere eines racemischen Wirkstoffs durch das aktive Zentrum eines Enzyms" verbirgt sich eine revolutionäre Erkenntnis, die die Realität besser abbildet als bisher bekannte Annahmen.
Gefährlicher Doppelgänger
In der Entwicklung von Medikamenten haben Moleküle eines Wirkstoffes häufig einen spiegelgleichen Doppelgänger. Nach bisheriger Meinung konnte an den entsprechenden Rezeptoren, den Bindetaschen einer Zelle, nur eines der beiden Enantiomere - das sind Verbindungen, die sich wie Bild und Spiegelbild verhalten - andocken. Im besten Fall "schwirrt" das zweite Enantiomer unnütz im Körper herum. In Einzelfällen kann dieses aber sehr gefährlich ausfallen, wie im Fall von Contergan, wo das Spiegelbild eines Enantiomers zu schwersten Missbildungen bei ungeborenen Kindern führte.
Beide Spiegelbilder in der Tasche
Die Wissenschafter haben ein völlig anderes Verhalten von bestimmten Enantiomeren entdeckt: Bei der Forschung an einem Enzym fand das Trio Bindetaschen, in denen beide Enantiomere eines getesteten Hemmstoffs gleichzeitig gebunden waren. Dieser der gängigen Lehrbuchmeinung widersprechende Befund trägt zu einem verbesserten Verständnis der Bindung von spiegelgleichen Verbindungen an Rezeptoren bei, wie er vor allem am Anfang der Medikamentenentwicklung eine Rolle spielt. "Die Entdeckung könnte interessante neue Perspektiven für die Pharmaforschung eröffnen", sagt Rolf Breinbauer: Zum einen könnte die Entwicklung von Medikamenten beschleunigt werden, was die enormen Kosten von ein bis zwei Milliarden Euro pro Medikament und damit auch den Handelspreis reduzieren würde; zum anderen könnten Medikamente früher auf den Markt kommen und trotzdem sicher sein.
Originalveröffentlichung: M. Mentel, W. Blankenfeldt, R. Breinbauer; "The Active Site of an Enzyme Can Host Both Enantiomers of a Racemic Ligand Simultaneously", Angew. Chem. Int. Ed. 2009, 48, 9084-9087
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.

















































