Forscher vermessen Proteinkorona
Anzeigen
Wie sich Nanopartikel im Körper verhalten, hängt nicht nur von ihrem chemischen Aufbau ab. Entscheidend ist, wie sie mit biologischen Molekülen wechselwirken. Professor Gerd Ulrich Nienhaus vom Karlsruher Institut für Technologie (KIT) hat neue Methoden entwickelt, mit der sich dieser dynamische Prozess quantitativ erfassen lässt.
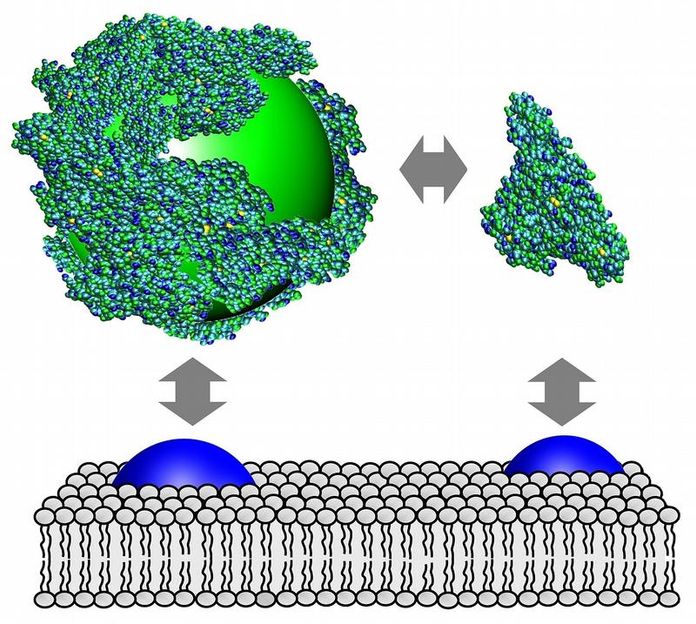
Proteine (blaugrün) umhüllen einen Nanopartikel (grün), der wie das freie Protein an der Zellmembran, z.B. an Rezeptoren (blau), anbinden kann.
CFN
Gelangt ein Nanopartikel ins Blut, wird er umgehend von einer dünnen Schicht aus Biomolekülen umhüllt. Diese als Proteinkorona bezeichnete biologische Oberflächenbeschichtung bestimmt maßgeblich, ob er einfach ausgeschieden wird oder ins Innere einer Körperzelle gelangen kann. "Nanopartikel, die fälschlicherweise in den Körper eindringen, möchte man schnell wieder loswerden. Wenn sie aber zum Beispiel therapeutisch eingesetzt werden, sollen sie von bestimmten Zelltypen gezielt aufgenommen werden. Deshalb ist es wichtig zu verstehen, wie körpereigene Moleküle an Nanopartikeln anbinden, denn über die Biomolekül-Schicht tritt ein Nanopartikel mit der Zelloberfläche in Kontakt", erläutert Nienhaus, der vor kurzem von der Universität Ulm an das Centrum für Funktionelle Nanostrukturen des KIT gewechselt hat. Seine in der Fachzeitschrift Nature Nanotechnology veröffentlichten Untersuchungsmethoden erlauben es, diese Fragen experimentell anzugehen.
Als Modellprotein wählte der Biophysiker Serumalbumin, ein wichtiges Blutprotein. Wenn es sich auf der Oberfläche eines Nanopartikels anlagert, nimmt dessen Durchmesser zu. In einer wässrigen Lösung bewegen sich Nanopartikel ständig. Diese Diffusionsbewegung wird bei zunehmender Partikelgröße langsamer. Um zu bestimmen, wie dick die Proteinschicht auf einem Nanopartikel ist, ermitteln Nienhaus und sein Team deshalb die Zeit, mit der sich der Partikel durch ein winziges Volumen Flüssigkeit bewegt.
Die Nanopartikel werden so hergestellt, dass sie Fluoreszenzlicht aussenden, wenn sie mit Licht bestrahlt werden. Daher kann man sie trotz ihres geringen Durchmessers von nur sechs bis acht Nanometern beobachten. Passiert ein Partikel in einem speziell entwickelten Mikroskop ein extrem kleines Flüssigkeitsvolumen in der Untersuchungskammer, wird es dort von einem Laserstrahl getroffen und sendet für einen Sekundenbruchteil Licht aus. Die Länge des Lichtblitzes kann präzise gemessen werden. Ist der Blitz kurz, bewegt sich der Partikel schnell, ist er lang, bewegt er sich langsam, was auf einen größeren Durchmesser schließen lässt. "Da wir wissen, wie groß ein Albuminmolekül ist, lässt sich daraus mit bekannten Formeln der Physik die Gesamt-Partikelgröße berechnen. Demnach ist die Proteinschicht auf einem Nanopartikel nur eine Moleküllage dick", fasst Nienhaus die Ergebnisse zusammen.
Aber wie schnell wird diese Hülle aufgebaut, und wie stabil ist sie? Zur Beantwortung dieser Frage markieren die Forscher die Proteine mit einem Farbstoff, der die Fluoreszenz des Nanopartikels abschwächt. Wenn die so behandelten Proteinmoleküle an einen Partikel binden, verringert sich dessen Leuchtintensität. Die Messdaten zeigen, dass ein Serumalbuminmolekül im Durchschnitt etwa 100 Sekunden auf der Partikeloberfläche haftet, bis es sich wieder ablöst und durch ein anderes ersetzt wird.
Nienhaus und sein Team wollen jetzt weitere Kombinationen von unterschiedlichen Biomolekülen und Nanopartikeln untersuchen. Auch Versuche an Zellkulturen werden durchgeführt um zu sehen, wie Zellen auf die umhüllten Nanopartikel reagieren. Die methodische Entwicklung des Karlsruhers eröffnet neue Messmöglichkeiten, die auch bei der Risikobewertung von Nanopartikeln wichtig sind.
Originalveröffentlichung: Carlheinz Röcker et al.; "A quantitative fluorescence study of protein monolayer formation on colloidal nanoparticles"; Nature Nanotechnology 4, 577 (2009)