Reparatur oder Totalschaden? - Wie DNA-Defekte bei der Krebstherapie helfen können
Die DNA, Trägerin der Erbinformation in unseren Zellen, ist permanent Angriffen ausgesetzt: durch Umwelteinflüsse wie ultraviolette, Röntgen- oder Gammastrahlung oder durch aggressive Sauerstoffradikale, die bei Stoffwechselvorgängen im Körper selbst entstehen. In der Folge kommt es häufig zu Schäden des Erbguts, die Alterungsprozesse in Gang setzen oder Krebserkrankungen auslösen können. Wissenschaftler des Deutschen Krebsforschungszentrums untersuchen nun die molekularen Mechanismen, die diesen Abläufen zu Grunde liegen. Die Landesstiftung Baden-Württemberg unterstützt das Forschungsvorhaben in den nächsten drei Jahren mit insgesamt 750.000 Euro.
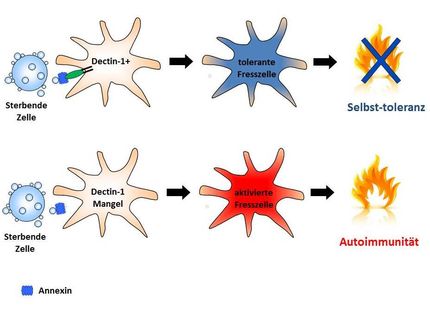
Um zu verhindern, dass DNA-Schäden zu Mutationen, also zu bleibenden Veränderungen der Erbinformation führen, verfügt der Körper über eine Vielzahl an Reparatursystemen. Diese helfen, Schäden zu erkennen und zu beheben. Je nachdem, wie groß der Schaden ausfällt, löst er unterschiedliche Programme aus: Die Zellen werden zunächst „kalt gestellt“, also an der Zellteilung und somit an der Vervielfältigung der fehlerhaften DNA gehindert. Geringere Defekte werden repariert, bei Zellen mit irreparablen Schäden startet der programmierte Zelltod, die Apoptose, oder das Zellalterungsprogramm, die Seneszenz. Die Zellen sterben ab oder verlieren dauerhaft ihre Fähigkeit, sich zu teilen.
Diesen Reaktionen des Organismus auf Schäden an der DNA liegt ein komplexes Netzwerk von Signalketten zugrunde. Ist es in seiner Funktion gestört, können Krebserkrankungen oder verfrühte Vergreisung (Progerie) die Folge sein. Ziel des Forschungsprojekts von Dr. Thomas Hofmann vom Deutschen Krebsforschungszentrum ist es, die molekularen Ereignisse aufzuklären, die den Zelltod oder die Zellalterung nach Schädigung des Erbguts auslösen.
"Eine zentrale Rolle spielt dabei das Enzym HIPK2", erklärt Hofmann. In gesunden Zellen ist das Enzym stumm geschaltet, bei irreparablen DNA-Schäden jedoch wird es aktiv und schickt die Zellen in den Tod. Diese Abläufe macht sich auch die Krebstherapie zunutze: Die Strahlen- oder Chemotherapie zielt darauf, die DNA von Tumorzellen so zu schädigen, dass schließlich das natürliche Zelltodprogramm eingeleitet wird und die Tumorzellen absterben. "Im nächsten Schritt wollen wir herausfinden, welche Mechanismen genau HIPK2 auf den Plan rufen", erläutert Hofmann weiter. "Dies könnte neue Ansatzpunkte für die Krebstherapie liefern, indem Tumorzellen durch die gezielte Aktivierung des Enzyms in den Selbstmord getrieben werden können."
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Zehe_(Fuß)