Bakterien induzieren Wirkstoffsynthese in Pilzen
Einen völlig neuen Weg der Regulation von Naturstoff-Synthesen haben Forscher am Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie – Hans-Knöll-Institut (HKI) – und der Friedrich-Schiller-Universität Jena entdeckt: Der Schimmelpilz Aspergillus nidulans bildet nur bei intensivem Kontakt mit bestimmten Bakterien eine Reihe von Substanzen, die in Reinkulturen des Pilzes bisher nie gefunden wurden. Das enge räumliche Miteinander der Mikroben aktiviert verschiedene Gene, die bislang als stille oder schlafende Gene bezeichnet wurden. Die Genprodukte führen dann zur Bildung von bisher bei diesem Pilz unbekannten Substanzen. Teams um Axel Brakhage und Christian Hertweck identifizierten in ausgetüftelten Experimenten die aus Flechten bekannten Substanzen Orsellinsäure und Lecanorsäure sowie die gegen Osteoporose wirksamen Verbindungen F-9775 A und B.
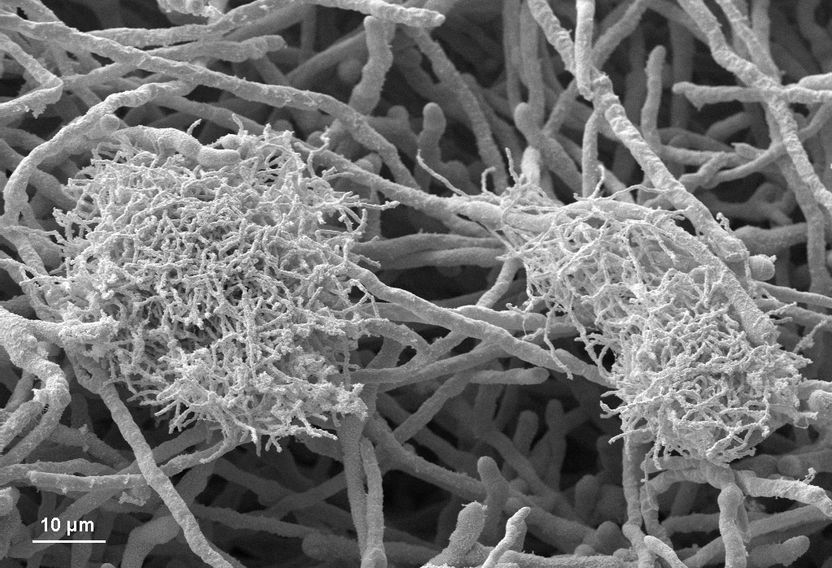
Flocken des Bakteriums Streptomyces hygroscopicus in engem Kontakt mit Mycel von Aspergillus nidulans.
HKI/FSU
Spätestens seit der Entdeckung des Penicillins vor 80 Jahren weiß man um die Bedeutung von Naturstoffen, die von Pilzen gebildet werden und ist in der Lage, dieses Potential für den Menschen zu nutzen. In sogenannten Screening- Programmen suchten die Pharmaindustrie und akademische Einrichtungen in Hunderttausenden von Mikroorganismen-Stämmen nach immer neuen Verbindungen, die vorzugsweise der Entwicklung von Arzneistoffen dienten. So wird ein Großteil der heute bekannten etwa 10.000 Antibiotika von Mikroorganismen produziert.
Der klassische Weg, an die begehrten Substanzen zu gelangen, ist die Reinkultur von Pilzen oder Bakterien in riesigen Fermentern von einigen Kubikmetern Fassungsvermögen. Hierzu verwendet man heute meist gentechnisch manipulierte Hochleistungsstämme. Inzwischen sind die Genome, also die gesamte Erbinformation, von vielen Mikroben vollständig entschlüsselt. Durch Vergleiche der DNA-Sequenz können die Wissenschaftler in zunehmendem Maße auch die Funktion ganzer Gruppen zusammengehörender Gene, sogenannter Gencluster, vorhersagen. Bei diesem als Genome mining bezeichneten Verfahren fiel auf, dass Pilze häufig Gencluster beherbergen, die eigentlich für die Synthese bestimmter Substanzen verantwortlich sein sollten. Bei der Kultivierung dieser Pilze im Labor fand man jedoch diese Substanzen nie, die betreffenden Gene „schliefen“ und konnten bislang auch nicht „geweckt“, sprich: aktiviert werden. Ein Blick zurück in die Natur, aus der die Pilze stammen, führte Axel Brakhage und Christian Hertweck auf die richtige Fährte: Mikroorganismen kommen nie isoliert vor, sondern immer vergesellschaftet mit anderen Arten. Kein Wunder, dass sich im Laufe der Evolution Kommunikationsprozesse entwickelt haben, die den Arten das Überleben sichern. Dabei geht es um die Bekämpfung gemeinsamer Gegner, die Besiedelung neuer Lebensräume und vieles mehr. Bei all diesen Vorgängen spielt der Austausch von chemischen Informationsträgern auch über Artgrenzen hinweg eine wesentliche Rolle. Bis heute war es weitgehend unbekannt, unter welchen natürlichen Bedingungen, solche stillen Gencluster aktiviert werden.
Die Forscher suchten nun eine Möglichkeit, um bei ihrem Modellobjekt Aspergillus nidulans, einem harmlosen Schimmelpilz, stille Gencluster zu aktivieren und deren Biosynthese-Potential nutzbar zu machen. Sie wählten hierfür gezielt eine Gruppe von Genen, die an der Biosynthese von Polyketiden beteiligt sein könnten, wie ihnen die Gensequenzen verrieten. Polyketide sind eine große Familie von Naturstoffen, die von vielen Pilzen und Pflanzen gebildet werden. Hierzu gehören Farbstoffe ebenso wie viele Antibiotika z. B. Tetrazyklin oder Pilzgifte wie Ochratoxin. Aspergillus nidulans ist im Erdboden weit verbreitet und daher lag es nahe, ihn mit Bakterien in Kontakt zu bringen, die den gleichen Lebensraum besiedeln und als seine natürlichen Kommunikationspartner in Frage kommen. Insgesamt 58 Vertreter der Actinomyceten wurden für einige Stunden gemeinsam mit dem Pilz kultiviert. Actinomyceten sind eine große Gruppe bodenbewohnender Bakterien, die selbst für die Synthese vieler Wirkstoffe bekannt sind. Anschließend analysierten die Biologen mit Hilfe von sogenannten Microarrays – kleinen Glasplatten, die mehrere tausend Genabschnitte eines Organismus tragen – Veränderungen im Genom von Aspergillus nidulans. Die dabei anfallende riesige Datenmenge wurde von Bioinformatikern des HKI ausgewertet. Sie waren es, die die gesuchte Aktivierung des stillen Genclusters nachweisen konnten: Einzig die gemeinsame Kultivierung des Pilzes mit dem Bakterium Streptomyces hygroscopicus führte dazu, dass die Synthese von Polyketiden angeschaltet wurde.
Die Naturstoffchemiker um Christian Hertweck isolierten aus einem großen Versuchsansatz die neu gebildeten Substanzen und führten eine Strukturaufklärung durch. Dabei konnten sie vier Substanzen identifizieren, die Aspergillus nidulans im Laborversuch noch nie gebildet hatte. Orsellinsäure und die eng verwandte Lecanorsäure sind archetypische Polyketide, die im Laufe der Evolution frühzeitig auftraten. Zwei weitere Verbindungen, die von Aspergillus nidulans nach Aktivierung der Synthesegene gebildet wurden, tragen bisher nur Nummern: F-9775A und B. Diese etwas komplexeren Moleküle blockieren ein Enzym, das an der Ausprägung der Osteoporose beteiligt ist. Sie könnten für die Therapie interessant sein.
Die Forscher gingen zunächst davon aus, dass Streptomyces hygroscopicus einen Signalstoff bildet, der die Synthese der neuen Substanzen im Pilz auslöst. Sämtliche Versuche, ein solches Botenmolekül nachzuweisen, schlugen jedoch fehl. Beispielsweise war es nicht möglich, die Genaktivierung herbeizuführen, wenn beide Organismen durch eine Membran getrennt waren, die für einen Signalstoff durchlässig war. Es half auch nichts, Pilzkulturen mit Nährlösung zu versetzen, in denen die Bakterien vorher gezüchtet wurden. Umso größer war die Überraschung angesichts elektronenmikroskopischer Bilder. Sie zeigten, dass sich die Bakterien im Inneren der vom Pilzgeflecht gebildeten Flocken ansammeln. Viele Bakterien schmiegten sich eng an die fadenförmigen Pilzzellen an und schienen eine größtmögliche Kontaktfläche zwischen beiden Organismen anzustreben. Offenbar ist es genau dieser enge physische Kontakt zwischen Bakterium und Pilz, der über einen noch unbekannten Mechanismus die Genaktivierung auslöst.
Das enge Beeinander der Mikroben erinnert an Symbiosen, bei denen sich mindestens zwei verschiedene Arten zum beiderseitigen Vorteil zusammenfinden. Ein Paradebeispiel sind Flechten. Sie sind Lebensgemeinschaften aus Pilzen und Grünalgen oder Cyanobakterien und für eine Vielzahl von Natur-, insbesondere Farbstoffen bekannt. Die Liaison ist im Gegensatz zum untersuchten System meist dauerhaft und untrennbar. Auch die nun bei Aspergillus nidulans wachgeküssten Substanzen Orsellin- und Lecanorsäure werden von Flechten gebildet.
Die soeben veröffentlichte Arbeit zeigt, dass auch seit langem bekannte und gut charakterisierte Mikroorganismen ein großes Potential an noch nicht entdeckten Substanzen bergen. Viele davon könnten für den Menschen nützlich sein. Diesen bislang unentdeckten Schatz zu heben bedarf es – wie im vorliegenden Fall geschehen – der engen Kooperation zwischen Wissenschaftlern unterschiedlichster Ausrichtung. Die Ergebnisse wurden im Rahmen der Jena School for Microbial Communication erzielt.
Originalveröffentlichung: Volker Schroeckh et al.; "Intimate bacterial–fungal interaction triggers biosynthesis of archetypal polyketides in Aspergillus nidulans"; PNAS published online before print August 6, 2009