Fluchthelfer statt Ordnungshüter
Anzeigen
Embryonalzellen haben wie metastasierende Krebszellen die Fähigkeit, zu wandern und in andere Gewebe einzudringen. Anhand von Untersuchungen an Froschembryonen konnten nun KIT-Wissenschaftler erstmals belegen, dass eine bekannte Verbindung, Cadherin-11, ausschlaggebend für die Zellwanderung ist. Dieses Glykoprotein ist auch verantwortlich für das fehlerhafte Zellverhalten bei Prostatakrebs und Arthritis.
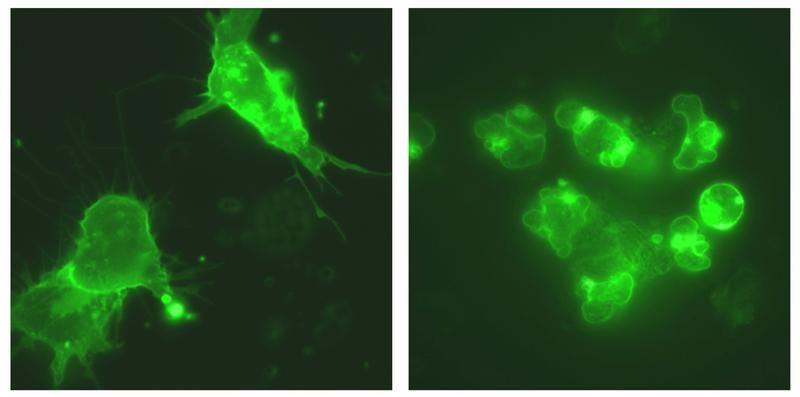
Wenn Cadherin-11 vorhanden ist (links) bilden die Zellen lange Zellausläufer, wenn es fehlt (rechts) sind die Zellen rund.
Jubin Kashef, Universität Karlsruhe
Normalerweise haben Cadherine die Aufgabe, Zellen zu verbinden. "Sie arbeiten im Prinzip wie ein Reißverschluss und verknüpfen Zellen miteinander zu einem Zellverband oder Gewebe", sagt Professorin Doris Wedlich, Leiterin des Zoologischen Instituts II des KIT. Die Moleküle verhindern, dass Zellen sich aus dem Zellverband lösen und auswandern. Cadherin-11, eines der rund 300 bei Wirbeltieren bekannten Cadherine, verhält sich jedoch insbesondere in Tumorzellen genau umgekehrt: Es löst eine Wanderbewegung aus. "Seine Gegenwart sorgt für die Bildung von Zellausläufern, den "Fingerspitzen" der Zellen, die den geeigneten Wanderungsweg ertasten", sagt Wedlich. Die KIT-Wissenschaftler gingen der Frage nach, warum gerade dieses Cadherin Tumorzellen zum Wandern animiert. Dazu untersuchten sie die Arbeitsweise von Cadherin-11 in Neuralleistenzellen, also frühen embryonalen Zellen, die unter anderem in das Gesichtsfeld einwandern, um dort die Gesichtsknochen zu bilden. "In der frühen Embryonalentwicklung gibt es erstaunliche Parallelen zu Tumoren", erklärt Entwicklungsbiologin Wedlich. Embryonalzellen sind daher ein interessantes Modellsystem, um die Tumorentstehung zu untersuchen. Denn das Verhalten ist von denselben Prinzipien geleitet, die einen Tumor ausmachen: Ihn kennzeichnet sein unkontrolliertes Wachstum, das heißt die ungebremste Zellteilung. Seine Zellen kommen ihrer ursprünglichen Aufgabe nicht mehr nach und verändern ihre Form. Sie nehmen alte Eigenschaften wieder an, etwa die Neigung zur Wanderung, und dringen in fremde Umgebung ein.
Erst seit kurzem gibt es Hinweise, dass Cadherin-11 bei der Metastasenbildung von Krebs und bei der Auslösung von Arthritis eine Rolle spielt, ohne dass der Funktionsmechanismus bisher verstanden wurde. "Jetzt wird klarer, warum Cadherin-11 auf Prostatatumorzellen zu finden ist, die bevorzugt in das Knochengewebe metastasieren", sagt Wedlich. "Ein ähnlicher Mechanismus scheint bei Gelenkentzündungen zu greifen. Cadherin-11 hilft, dass Zellen, welche die Gelenkkapsel auskleiden, fälschlicherweise den Knochen besiedeln." Mithilfe molekularbiologischer Methoden fand das Team um Professorin Wedlich heraus, dass erst die Bindung von spezifischen Adaptorproteinen an Cadherin-11, nämlich Trio zusammen mit beta-Catenin, die Ausbildung von Zellfortsätzen und damit die Wanderbewegung der Zelle auslöst. Anhand von genetisch veränderten Cadherin-Molekülen, denen bestimmte Abschnitte fehlten, konnten die Wissenschaftler die Bindungsregion von Trio im Cadherin eingrenzen. "Trio wirkt innerhalb der Zelle ganz spezifisch auf Cadherin-11", sagt Doris Wedlich. "Um das durch Cadherin-11 ausgelöste Fehlverhalten von Zellen zu verhindern, bietet es sich an, die Kopplung von Trio an Cadherin-11 gezielt zu blockieren."
Zurzeit beschäftigt sich die KIT-Nachwuchsgruppe von Jubin Kashef mit den Fragen, welche strukturellen Merkmale die Bindungsstellen von Trio und Cadherin-11 aufweisen und welche Faktoren nach Kopplung der beiden Proteine aktiviert werden. "Wenn es uns gelingt, diese Fragen zu beantworten, könnten wir den Signalweg unterbrechen und damit die Wanderbewegung der Zellen unterbinden", zeichnet Doris Wedlich eine langfristige Perspektive auf.
Originalveröffentlichung: Jubin Kashef et al.; "Cadherin-11 regulates protrusive activity in Xenopus cranial neural crest cells upstream of Trio and the small GTPases"; Genes & Development 2009, 23 (12)