Neuer Signalweg bei Bakterien entdeckt
Forscher am Wiener Institut für Molekulare Pathologie (IMP) identifizierten ein bakterielles Enzym, das Signale auf bisher unbekannte Weise überträgt. Die Entdeckung könnte die Entwicklung neuartiger, gezielt wirkender Antibiotika ermöglichen.
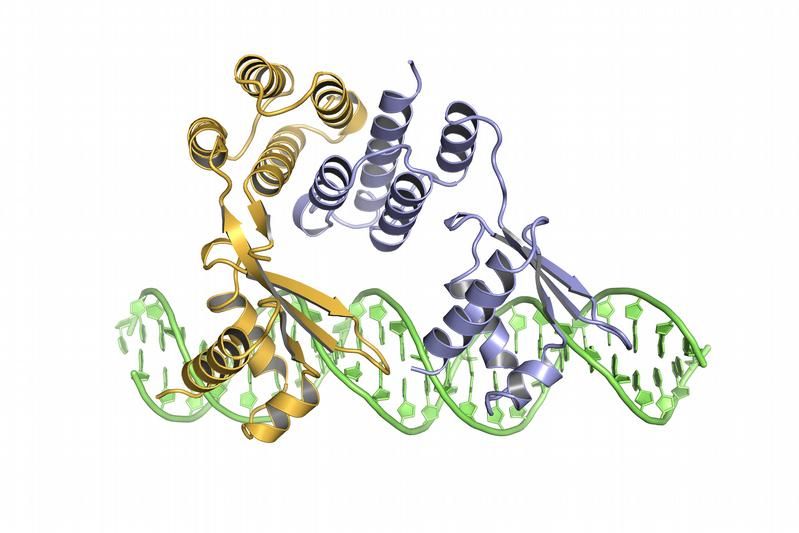
Dreidimensionale Darstellung des Regulatorproteins CtsR, an DNA gebunden (CtsR bestehend aus 2 Untereinheiten in violett und ocker).
IMP
Proteine sind Ketten aus Aminosäuren, die sich im Raum zu dreidimensionalen Strukturen falten. Sie werden von einer zelleigenen Maschinerie produziert, die die Anweisungen der Gene in die Reihenfolge der Kettenglieder übersetzt. Ein Gen - ein Protein, das war lange Zeit ein Dogma der Molekularbiologie. Mittlerweile kennt die Wissenschaft zahlreiche Modifikationen, mit denen Proteine nach ihrer Synthese aufgepeppt werden: durch Anhängen von kleinen Molekülen, Bildung von chemischen Brücken, Abspalten von Aminosäuren oder Anfügen und Durchtrennen von Eiweißketten wird das Funktionsspektrum der Proteine dramatisch erweitert. Die Vielfalt an Regulationsmöglichkeiten erklärt auch das Paradox der relativ geringen Anzahl von Genen beim Menschen.
Eine der häufigsten und wichtigsten Modifikationen ist die Phosphorylierung. Durch Hinzufügen und Abspalten von Phosphatresten kann die Funktion eines Proteins sehr präzise kontrolliert werden. Wie mit einem molekularen Schalter werden auf diese Weise etwa Enzyme ein- und ausgeknipst. Die Zelle nutzt das reversible System unter anderem, um Signale aufzunehmen und weiterzuleiten. Der Mechanismus ist bewährt, er wurde von den einzelligen Bakterien bis zum Menschen beibehalten. Die Überträger der Phosphatreste, die Kinasen, spielen daher in allen Organismen eine zentrale Rolle im Stoffwechsel. Sie sind auch an der Entstehung von Krankheiten und am Wachstum von Tumoren beteiligt und daher ein wichtiger Angriffspunkt bei der Entwicklung von neuen, selektiv wirkenden Medikamenten.
Wissenschaftler am Forschungsinstitut für Molekulare Pathologie haben nun eine neue Klasse von Kinasen aufgespürt. Mit biochemischen und strukturbiologischen Methoden gelang es der Gruppe um Tim Clausen, eine sogenannte Protein Arginin-Kinase zu identifizieren. Die Forscher isolierten das Enzym aus Bacillus stearothermophilus, einem wärmeliebenden Bodenbakterium. In der der Zeitschrift Science beschreiben sie ihre Erkenntnisse und Methoden.
Die neu beschriebene Kinase trägt die Bezeichnung McsB und spielt eine Rolle bei der Stressantwort des Bakteriums. Mit Stress - wie zum Beispiel Hitze - umzugehen, ist für alle Lebewesen eine große Herausforderung. Gerade Mikroorganismen haben dabei oft erstaunliche Strategien entwickelt. Bakterien, die in Zellen eindringen und Krankheiten auslösen, sind etwa umso virulenter je besser sie sich gegen Fieber wappnen können.
B. stearothermophilus selbst ist kein Krankheitserreger, kann aber Lebensmittel verderben. Der Organismus fühlt sich bei Temperaturen um 55 Grad am wohlsten. Das hat für die Forscher den Vorteil, dass seine Proteine sehr stabil sind und auch gröbere Untersuchungsmethoden überstehen.
Bei Hitzestress wird das Enzym McsB aktiv. Es überträgt einen Phosphatrest an ein Regulatorprotein namens CtsR, das normalerweise an DNA gebunden ist und dort das Ablesen von Stressgenen blockiert. Mit der Phosphorylierung ändern sich die Ladungsverhältnisse, die Bindung an die DNA geht verloren.
Was den Vorgang für die Wissenschaft so interessant macht: McsB hängt die Phosphatgruppe an die Aminosäure Arginin an und nicht wie sonst üblich an Serin, Threonin oder Tyrosin. Der Nachweis dafür war nicht leicht zu führen, für die Analyse von Phosphoarginin musste erst eine neue Methode entwickelt werden. Besonders hilfreich dabei war die enge Zusammenarbeit mit der IMP-IMBA Servicegruppe für Massenspektrometrie unter Karl Mechtler. Auch eine Arbeitsgruppe der Max F. Perutz Laboratories unter Emmanuelle Charpentier war an dem Projekt beteiligt.
Für den IMP-Doktoranden Jakob Fuhrmann ergeben sich aus der Arbeit spannende Zukunftsperspektiven. "Der neue und seltene Signalweg könnte medizinisch interessant werden, etwa als Angriffsziel für spezifisch wirkende Antibiotika", erläutert Fuhrmann. Immerhin sind Krankheitserreger wie Staphylokokken und Listerien enge Verwandte des untersuchten Bazillus und besitzen die gleichen Stressgene.
In einem nächsten Schritt wollen die IMP-Forscher nun untersuchen, ob Protein Arginin-Kinasen auch beim Menschen vorkommen. Sollten sie exklusiv zur Ausstattung von Mikroorganismen zählen, wäre eine Intervention mit Medikamenten besonders gezielt und nebenwirkungsarm.
Originalveröffentlichung: Jakob Fuhrmann et al.; Science 5 June 2009
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!