Nanocarrier avec réflexe de fuite
Libération de médicaments spécifiques aux tumeurs grâce à un échappement endosomal contrôlé
Les médicaments à base de protéines doivent être transportés dans les cellules de manière à empêcher leur dégradation immédiate. Une nouvelle approche vise à garantir qu'ils restent intacts uniquement dans certaines cellules, telles que les cellules cancéreuses. Dans la revue Angewandte Chemie, une équipe de recherche japonaise a présenté un nanocarrier capable de "s'échapper" des endosomes avant que sa cargaison n'y soit détruite. Cette capacité à s'échapper n'est déclenchée que dans les endosomes de certaines cellules tumorales.
© Wiley-VCH
L'absorption des nanocarriers dans les cellules se fait par endocytose : lorsqu'un nanocarrier arrive à la surface de la cellule, la membrane cellulaire se replie et l'enferme dans une bulle, appelée endosome, qui dérive ensuite à l'intérieur de la cellule. Dans sa phase tardive, l'endosome fusionne avec des lysosomes qui contiennent des enzymes, formant ainsi un endolysosome. Dans cette structure, les enzymes décomposent à la fois le matériel de l'organisme et le matériel étranger. Un médicament à base de protéines ne peut devenir actif que s'il "échappe" à l'endolysosome avant d'être dégradé. C'est ce que l'on appelle "l'échappement endosomal". Certains nanocarriers peuvent ouvrir la membrane endo/lysosomale et ont donc la capacité de s'échapper de l'endosome.
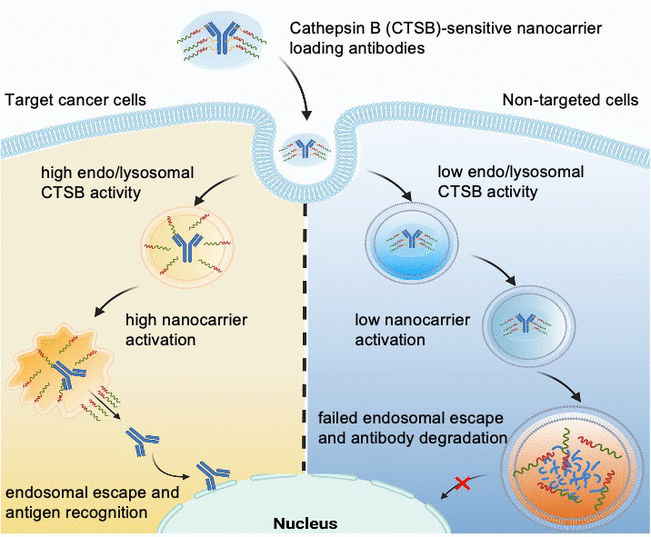
Dirigée par Kazunori Kataoka et Horacio Cabral, l'équipe souhaite aller plus loin en produisant des nanocarriers pour lesquels l'échappement endosomal n'est déclenché que lorsqu'ils pénètrent dans des cellules très spécifiques, telles que les cellules tumorales. Les cellules saines seraient ainsi protégées. Les chercheurs exploitent le fait que les différents types de cellules ont des activités enzymatiques endolysomales très différentes. Par exemple, l'activité de la protéase cathepsine B (CTSB) est particulièrement élevée dans les cellules cancéreuses.
En utilisant des molécules sondes de fluorescence spéciales, l'équipe de l'Université de Tokyo et de l'Institut de promotion industrielle de Kawasaki a d'abord étudié l'activité de la CTSB et la dégradation des protéines dans les endosomes. Ils ont déterminé que dans les cellules cancéreuses dont les endosomes sont très acides, l'activité du CTSB est déjà très élevée dans leur phase initiale, bien avant que la dégradation des protéines ne s'accélère. Les chercheurs tirent parti de cette fenêtre temporelle en utilisant des nanocarriers dont la capacité d'évasion endosomale est déclenchée par le CTSB dans les cellules cancéreuses.
L'équipe a construit des nanocarriers à base de poly(éthylène glycol) avec des groupes diaminoéthane capables de "déchirer" les membranes endo/lysosomales. À l'aide d'un liant, ils ont ensuite fixé des anticorps pour servir de modèle à une protéine médicamenteuse. Le nanocarrier protège les "outils de déchirure" de sorte qu'ils sont initialement inactifs. Le linker est conçu pour être divisé par le CTSB dans les endolysosomes. Cela sépare la cargaison du transporteur, activant ainsi les outils de déchirure. Ceux-ci ouvrent la membrane endo/lysosomale et libèrent des anticorps intacts à l'intérieur de la cellule, mais uniquement dans les cellules tumorales qui ont une activité CTSB endosomale élevée.
Cette méthode pourrait représenter une nouvelle stratégie pour la libération de médicaments spécifiques aux cellules par le biais de nanocarriers sensibles aux stimuli et dont l'échappement endosomal est contrôlé.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.



































