Biologie structurale : Des ciseaux moléculaires pris sur le fait
La structure d'une enzyme cruciale pour la maturation de l'ARNt éclaire la cause des troubles neurodégénératifs
Dans tous les organismes vivants, la biomolécule ARN de transfert (ARNt) joue un rôle fondamental dans la production de protéines. Les ARNt sont générés à partir de molécules précurseurs en plusieurs étapes. L'enzyme tRNA splicing endonuclease (TSEN), entre autres, catalyse une étape de ce processus. Les mutations de la TSEN entraînent une maladie neurodégénérative appelée hypoplasie pontocérébelleuse, qui est associée à de graves handicaps et à une mort prématurée. Des chercheurs de l'université Goethe de Francfort et de l'université Johannes Gutenberg de Mayence ont maintenant déduit la fonction de TSEN à partir de sa structure et ont ainsi ouvert la voie à la recherche de substances actives contre l'hypoplasie pontocérébelleuse.
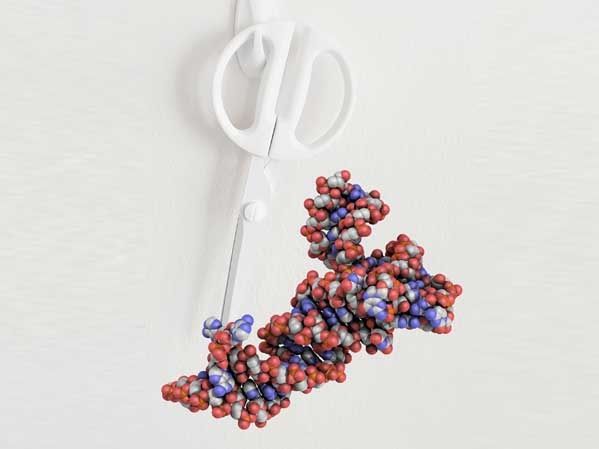
Paré : Comme des ciseaux, l'enzyme TSEN façonne l'ARNt (coloré) en enlevant des parties de la molécule précurseur, le pré-ARNt.
Trowitzsch Lab, Goethe-Universität
Les ARN de transfert (ARNt) font partie des types d'ARN les plus courants dans une cellule et sont indispensables à la production de protéines dans tous les organismes connus. Ils ont une importante fonction de "traduction" : Ils déterminent comment la séquence d'acides nucléiques, dans laquelle l'information génétique est codée, est transcrite en une séquence d'acides aminés à partir de laquelle les protéines sont construites.
Les ARN de transfert sont générés à partir d'ARNt précurseurs (pré-ARNt), qui sont convertis en plusieurs étapes en ARNt mature doté d'une structure tridimensionnelle complexe. Pour certains ARNt, cette conversion comprend une étape au cours de laquelle une certaine section, connue sous le nom d'intron, est excisée. Chez l'homme, c'est l'endonucléase d'épissage de l'ARNt (TSEN) qui accomplit cette tâche.
L'enzyme ARN kinase CLP1, qui se lie directement à la TSEN, joue également un rôle dans la conversion correcte des ARNt. Si TSEN et CLP1 ne peuvent pas interagir l'un avec l'autre en raison d'une mutation génétique, il semble que les ARNt ne puissent pas non plus se former correctement. Les conséquences de ce phénomène sont souvent observées dans le développement de troubles neurodégénératifs. L'une d'entre elles est l'hypoplasie pontocérébelleuse, qui entraîne de graves handicaps et une mort prématurée dans la petite enfance. Cette maladie progressive très rare se manifeste par un développement anormal du cervelet et du pons, une partie du tronc cérébral.
Bien que l'activité de la TSEN soit essentielle à la vie, la façon dont l'enzyme se lie aux pré-ARNt et dont les introns sont excisés n'était jusqu'à présent pas très claire. L'absence de structure tridimensionnelle de l'enzyme rendait également difficile l'évaluation des changements déclenchés par des mutations pathogènes spécifiques. Grâce à la cryo-microscopie électronique (cryo-EM) réalisée dans les installations de l'université Julius-Maximilians de Würzburg et de l'institut de biochimie de l'université Goethe de Francfort, des chercheurs dirigés par le Dr Simon Trowitzsch de l'institut de biochimie de l'université Goethe ont réussi à mettre en lumière la structure tridimensionnelle d'un complexe TSEN/pré-ARNt.
Grâce à leurs reconstructions cryo-EM, l'équipe de recherche a pu montrer pour la première fois comment la TSEN interagit avec le pré-ARNt en forme de L. La TSEN excise ensuite l'intron et le pré-ARNt. TSEN excise ensuite l'intron du bras long du L. "TSEN s'installe d'abord dans l'angle du L. Elle peut ensuite reconnaître le bras court et le bras long ainsi que l'angle entre les deux", explique Trowitzsch.
La sous-unité 54 de la TSEN (TSEN54) joue un rôle clé dans la reconnaissance du pré-ARNt, comme les chercheurs ont pu le confirmer. La sous-unité sert de "règle moléculaire" et mesure la distance entre le bras long et le bras court du L. De cette façon, la TSEN reconnaît à quel moment le pré-ARNt doit être clivé afin d'éliminer l'intron.
Les nouvelles découvertes concernant l'interaction entre l'ARN kinase CLP1 et la sous-unité TSEN54 de la TSEN ont été surprenantes : CLP1 se lie manifestement à une région non structurée et donc très flexible de TSEN54. C'est précisément cette région qui contient un acide aminé le plus souvent muté chez les patients atteints d'hypoplasie pontocérébelleuse. "Pour nous, il s'agit d'une indication importante que le développement de médicaments devrait à l'avenir se concentrer sur le maintien de l'interaction entre TSEN et CLP1", est convaincu Samoil Sekulovski, premier auteur de l'étude.
Les scientifiques espèrent maintenant que les données structurelles permettront de simuler des modèles qui pourront être utilisés pour rechercher des substances actives potentielles. Trowitzsch résume la situation : "Bien qu'une thérapie prometteuse soit encore loin de nous, notre structure constitue une base solide pour une meilleure compréhension du fonctionnement de la TSEN et des schémas pathologiques de ses mutants."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.