Les structures des virus mortels ouvrent de nouvelles voies pour la conception de vaccins
En comparant les structures des complexes protéiques de différentes lignées du dangereux virus de Lassa, une équipe de Scripps Research a identifié de nouveaux anticorps et de nouvelles cibles vaccinales
Chaque année, des centaines de milliers de personnes en Afrique de l'Ouest sont infectées par le virus de Lassa, qui peut provoquer la Fièvre de Lassa et entraîner une maladie grave, des effets secondaires à long terme ou la mort. Il n'existe actuellement aucun traitement ou vaccin largement approuvé pour cette maladie. Aujourd'hui, des scientifiques de Scripps Research ont déterminé la structure du complexe protéique critique qui permet au virus Lassa d'infecter les cellules humaines. Cette recherche, publiée en ligne dans Cell Reports, a également permis d'identifier de nouveaux anticorps qui se lient à ces protéines et neutralisent le virus, ouvrant ainsi la voie à des vaccins et des traitements plus efficaces contre le virus de Lassa.
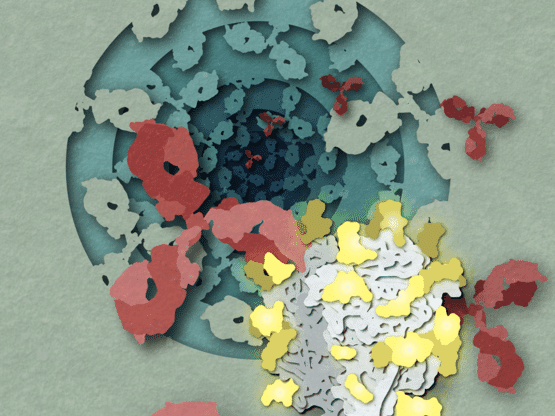
Illustration d'anticorps (rouge) recherchant le complexe glycoprotéique du virus de Lassa (GPC, blanc) dans la circulation sanguine humaine. De nouvelles recherches sur la structure de la GPC, qui est enrobée de molécules de sucre (jaune), ont aidé les chercheurs à définir ses interactions avec les anticorps efficaces.
Hailee Perrett, Scripps Research
"Ces travaux constituent un grand pas en avant dans notre capacité à isoler de nouveaux anticorps sur des sites pertinents de vulnérabilité du virus, et ils fournissent une base pour la conception rationnelle de vaccins destinés à protéger largement les personnes contre de nombreuses lignées du virus de Lassa", déclare l'auteur principal Andrew Ward, PhD, professeur de biologie structurelle intégrative et computationnelle à la Scripps Research. "Ces nouveaux réactifs décrits dans l'article sont déjà utilisés à bon escient et donnent de nouveaux résultats passionnants."
Comme de nombreux virus, le virus de Lassa existe dans une variété de lignées, chacune avec de légères variations dans ses gènes. Cette diversité a rendu difficile l'identification des anticorps qui reconnaissent toutes les versions du virus de Lassa. Les scientifiques ont également eu du mal à isoler les glycoprotéines du virus de Lassa, ces protéines en forme de pointe qui entourent le virus et qui sont la cible de la plupart des anticorps. Dans le virus infectieux, ces glycoprotéines existent en complexes de trois, appelés trimères. Cependant, pendant des décennies, les scientifiques n'ont pu isoler les glycoprotéines en laboratoire que sous forme de protéines individuelles et non dans leurs complexes de trimères.
En 2022, Ward et ses collègues ont découvert comment utiliser des nanoparticules pour maintenir les glycoprotéines ensemble en trimères. Dans leurs nouveaux travaux, ils ont utilisé cette technique pour isoler et caractériser structurellement des trimères de glycoprotéines provenant de quatre lignées différentes du virus de Lassa. Étonnamment, les structures des glycoprotéines des différentes lignées étaient extrêmement similaires.
"Nous espérions voir des différences plus évidentes qui expliqueraient pourquoi les anticorps ne reconnaissaient pas toutes les lignées", explique Hailee Perrett, étudiante diplômée de Scripps Research et premier auteur de l'étude. "Au lieu de cela, nous avons constaté un très haut niveau de conservation entre les composants peptidiques et sucrés de la protéine".
En utilisant les mêmes glycoprotéines stables, Ward, Perrett et leurs collègues ont ensuite utilisé des échantillons de sang de patients guéris du virus de Lassa pour isoler des anticorps contre les trimères de glycoprotéines. Ils ont trouvé de nouveaux anticorps et caractérisé des anticorps précédemment découverts qui reconnaissent différentes lignées de la glycoprotéine du virus de Lassa, ce qui pourrait être utile pour développer un traitement ou un vaccin préventif contre le virus.
L'équipe planifie déjà de futures expériences pour identifier d'autres anticorps contre les glycoprotéines du virus de Lassa, ainsi que pour analyser plus en détail les structures des protéines afin d'identifier les endroits sur les glycoprotéines qui sont idéaux pour être ciblés avec des médicaments.
"Nos objectifs étaient non seulement de tenter de définir certains détails structurels de ces différents virus Lassa, mais aussi de fournir des protocoles et des ressources de base pour le domaine", explique M. Perrett. "Nous espérons que nos approches et nos premiers résultats contribueront à faire avancer la science dans ce domaine.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.





































