L'enzyme de l'oiseau ouvre la voie à de nouvelles thérapies
Des scientifiques de l'université Rice dotent les cellules d'une voie "non canonique" pour fabriquer leurs propres médicaments.
Remercions l'ibis huppé, une espèce rare, pour un indice qui pourrait un jour aider nos organismes à fabriquer de meilleurs médicaments.

Remerciez l'ibis huppé, espèce rare, pour un indice qui pourrait un jour aider notre corps à fabriquer de meilleurs médicaments (image symbolique).
Computer generated picture
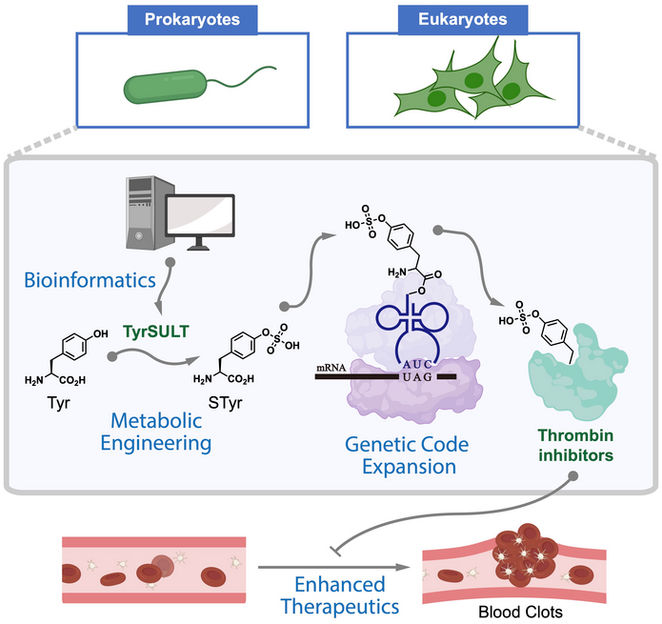
Un graphique montre comment les chimistes de l'université Rice ont utilisé une voie génétique rare pour modifier le métabolisme de cellules qui servent d'usines à médicaments pour fabriquer des inhibiteurs de la thrombine qui brisent les caillots sanguins. L'étude a commencé par une enquête bioinformatique qui a permis de trouver la clé chez un ibis huppé.
Xiao Lab/Rice University
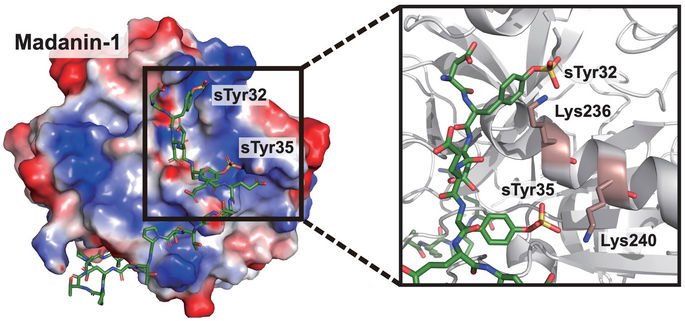
Les scientifiques de l'université Rice ont mis au point des cellules modifiées pour exprimer des protéines thérapeutiques, notamment un inhibiteur de la thrombine. La clé est l'insertion spécifique d'un site de sulfotyrosine (sTyr), un mutant de l'acide aminé standard tyrosine que l'on ne trouve naturellement que chez l'ibis huppé.
Xiao Lab/Rice University

Cette espèce d'oiseau est la seule connue pour produire naturellement une enzyme capable de générer un acide aminé non canonique, c'est-à-dire un acide aminé qui ne figure pas parmi les 20 nécessaires pour coder la plupart des protéines.
L'existence de cette enzyme, découverte grâce à la comparaison informatique des bases de données sur les génomes, prouve qu'il est possible qu'elle fonctionne dans le contexte des cellules vivantes, même si les scientifiques ne savent pas ce qu'elle fait pour l'oiseau.
Mais ils ont une assez bonne idée de ce qu'elle pourrait faire pour nous.
Une nouvelle étude menée par Han Xiao, chimiste à l'université Rice, Peter Wolynes, physicien théoricien, et leurs collègues montre que l'acide aminé sulfotyrosine (sTyr), un mutant de l'acide aminé standard tyrosine, est un élément clé pour programmer des cellules vivantes qui expriment des protéines thérapeutiques. Il pourrait potentiellement permettre aux cellules de servir de capteurs qui surveillent leur environnement et y répondent avec le traitement nécessaire.
Pour imiter la capacité de l'ibis à synthétiser le sTyr et à l'incorporer dans les protéines, il faut modifier l'ADN d'une cellule avec un codon mutant qui, à son tour, fabrique l'enzyme transférase, la sulfotransférase 1C1, présente chez l'oiseau. Celle-ci catalyse la génération de sTyr, un fragment de reconnaissance essentiel dans une variété d'interactions biomoléculaires.
L'étude de preuve de concept a produit pour la première fois des cellules de mammifères qui synthétisent du sTyr. Dans une expérience, le laboratoire de Xiao a fabriqué des cellules qui ont renforcé l'efficacité des inhibiteurs de la thrombine, des anticoagulants utilisés pour empêcher la coagulation du sang.
L'étude est publiée dans Nature Communications.
"Dans la nature, la plupart de nos espèces sont constituées de 20 blocs de construction canoniques", a déclaré M. Xiao. "Si vous voulez ajouter un bloc de construction supplémentaire, vous devez réfléchir à la manière de le fabriquer. Nous avons résolu ce problème : nous pouvons demander à la cellule de le fabriquer.
"Mais il faut ensuite disposer de la machinerie de traduction pour le reconnaître. Et un codon spécial pour coder ce nouveau bloc de construction", a-t-il ajouté. "Avec cette étude, nous avons rempli ces trois conditions".
Xiao a reçu une subvention des National Institutes of Health en 2019 pour voir si les cellules pouvaient être programmées pour fabriquer des substances avec des acides aminés supplémentaires. La nouvelle étude démontre les progrès spectaculaires du laboratoire.
Jusqu'à présent, les scientifiques introduisaient dans les cellules des acides aminés non canonique synthétisés chimiquement. Il est beaucoup plus efficace de laisser la cellule faire le travail, a déclaré Xiao, mais cela nécessite la découverte d'une nouvelle enzyme transférase avec des poches de tyrosine qui pourraient lier le sulfate. Cette combinaison pourrait alors être utilisée comme base pour une variété de catalyseurs.
"Désormais, grâce à cette nouvelle stratégie de modification des protéines, nous pouvons totalement changer la structure et la fonction d'une protéine", a-t-il déclaré. "Pour nos modèles d'inhibiteurs de la thrombine, nous avons montré que le fait de mettre un bloc de construction non naturel dans le médicament peut rendre le médicament beaucoup plus puissant."
Cela valait la peine de regarder si la nature les avait devancés sur un codon utile. Pour cela, Xiao a fait appel à Wolynes, codirecteur du Centre de physique biologique théorique, dont le laboratoire a comparé les bases de données génomiques et a trouvé la sulfotransférase 1C1 chez l'ibis.
Le laboratoire de Xiao a utilisé un codon stop ambré mutant, un groupe de trois nucléotides composé d'uracile, d'adénine et de guanine, pour coder la sulfotransférase souhaitée, ce qui a donné lieu à une lignée cellulaire mammalienne complètement autonome, capable de biosynthétiser le sTyr et de l'incorporer avec une grande précision dans les protéines.
"Nous avons eu de la chance", a déclaré Xiao. "L'ibis est la seule espèce à faire cela, ce qui a été découvert par une recherche de similarité de séquence des informations génomiques. Après cela, nous avons demandé s'ils pouvaient comprendre pourquoi cette enzyme reconnaît la tyrosine mais pas notre sulfotransférase humaine."
L'équipe de Wolynes a utilisé AlphaFold2, un programme d'intelligence artificielle développé par DeepMind d'Alphabet/Google qui prédit les structures des protéines.
Les chercheurs espèrent utiliser la combinaison de la bioinformatique et du criblage assisté par ordinateur pour produire une bibliothèque d'acides aminés non canonique biosynthétisés.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.


































